脊髓脑膜瘤,作为中枢神经系统肿瘤的一种,其诊断频率远低于颅内脑膜瘤。尽管临床表现可能看似均一,但深入的分子生物学研究正逐渐揭示其背后复杂的基因组和表观遗传学图谱。理解这些分子特征对于实现脊髓脑膜瘤的精准分类、预后判断以及开发更有效的靶向治疗策略至关重要。本文将基于一项对胸段脊髓脑膜瘤的基因组与表观遗传学联合分析研究,深入探讨其分子驱动因素,特别是NF2、AKT1和SMARCB1等常见突变,并展望分子分型在临床实践中的应用前景,以及靶向治疗药物如布格替尼、克唑替尼等在此类肿瘤管理中的潜力。
脑膜瘤概览:从颅内到脊髓
脑膜瘤是成人最常见的中枢神经系统原发肿瘤,起源于脑膜细胞,可发生于神经轴的任何部位。根据世界卫生组织(WHO)的分类,脑膜瘤分为I级(良性)、II级(非典型)和III级(恶性)。绝大多数脑膜瘤为良性,生长缓慢,可能长期无症状,仅通过影像学监测。然而,部分脑膜瘤,特别是位于关键神经血管结构附近的肿瘤,可能压迫周围组织,引起疼痛、感觉异常、肢体无力或步态障碍等症状,此时通常需要手术切除。
虽然颅内脑膜瘤的研究已较为深入,其多样化的遗传景观和表观遗传特征已被广泛证实,但脊髓脑膜瘤(SMs)的分子生物学研究相对有限。脊髓脑膜瘤约占所有脑膜瘤的1%–12%,是硬膜内脊髓肿瘤中常见的类型。近年来,随着基因测序技术的进步,研究人员开始关注脊髓脑膜瘤的遗传改变及其与临床表现的关联,为我们理解这种肿瘤提供了新的视角。
脊髓脑膜瘤的分子景观:基因突变与表观遗传学
脊髓脑膜瘤的分子特征是其精准诊断和治疗的基础。通过靶向基因组测序和DNA甲基化谱分析,研究人员得以揭示这些肿瘤独特的遗传和表观遗传学面貌。
基因驱动突变:NF2、AKT1与SMARCB1
在脑膜瘤的发生发展中,基因突变扮演着关键角色。本研究以及其他多项研究均指出,NF2、AKT1和SMARCB1是脊髓脑膜瘤中最常见的驱动基因突变:
- NF2基因突变: 神经纤维瘤病2型(NF2)是一种遗传性疾病,由NF2抑癌基因突变引起,患者常伴有多发性脑膜瘤。在散发性脑膜瘤中,NF2功能缺失突变也极为常见,尤其是在胸椎部位的脊髓脑膜瘤中。NF2基因编码一种名为Merlin的肿瘤抑制蛋白,参与细胞骨架与细胞膜的连接,调控细胞生长、增殖和迁移。NF2突变导致Merlin功能丧失,进而促进肿瘤细胞的异常增殖。
- AKT1基因突变: AKT1基因编码一种丝氨酸/苏氨酸激酶,是PI3K/AKT信号通路的关键组分,该通路在细胞生长、增殖、代谢和存活中发挥重要作用。AKT1的激活型突变(如E17K)可导致PI3K/AKT通路异常激活,促进肿瘤生长。研究表明,AKT1E17K突变型脊髓脑膜瘤更常见于颈椎,且多位于腹侧/腹外侧。
- SMARCB1基因突变: SMARCB1是SWI/SNF染色质重塑复合物的一个亚基,该复合物在基因表达调控、DNA修复和细胞周期控制中发挥关键作用。SMARCB1的功能缺失突变与多种肿瘤的发生发展相关,包括脑膜瘤。本研究发现SMARCB1 R377H功能缺失突变,有时可与NF2突变共存,进一步增加了肿瘤的遗传复杂性。
除了上述主要驱动基因外,研究还发现其他参与Wnt/β-连环蛋白(APCR2505Q)、Notch(NOTCH3P2033S)、MAPK/ERK(MAPK1)和生长因子(EGFRV904I、FGFR3P63R)信号通路的基因也存在突变。这些信号通路的调控功能障碍通常与肿瘤增殖增强相关,反映了脊髓脑膜瘤遗传图谱的丰富多样性。
DNA甲基化谱分析:肿瘤分类的新维度
除了基因突变,表观遗传学改变,特别是DNA甲基化,也被认为是脑膜瘤分类和预后判断的重要生物标志物。DNA甲基化是一种不改变DNA序列但影响基因表达的机制。通过全基因组DNA甲基化谱分析,可以将脑膜瘤分为不同的分子亚类,这些亚类与肿瘤的生物学行为、复发风险和预后密切相关。
本研究将样本归类为“良性特征”(良性1型、良性2型)和“中间型特征”(中间型A)。通常,包含钙化砂粒体的纤维母细胞型脑膜瘤与良性甲基化亚类相关,而中间甲基化类别则常与WHO II级非典型脑膜瘤相关,预示着更高的侵袭性和复发风险。DNA甲基化分类的差异也体现在临床上:良性亚类通常与更高的肿瘤全切除率和更有利的无进展生存期相关。因此,DNA甲基化谱分析为脊髓脑膜瘤的分子分型提供了重要的补充信息,有助于更全面地评估肿瘤的侵袭性。
研究方法与核心发现
本研究对8例原发性胸段脊髓脑膜瘤患者进行了整合基因组和DNA甲基化分析,旨在深入理解其分子特征。
患者队列与临床表现
研究纳入的8例患者以女性为主(87.5%),手术时中位年龄为68岁。患者的临床表现相对均一,主要包括感觉异常(62.5%)、行走功能障碍(50%)和无力(50%),部分患者有尿失禁(12.5%)。所有肿瘤均位于胸椎的硬膜内髓外,平均大小为3.3 cm³。所有患者均接受了完整手术切除,术后神经症状显著改善,且在6个月和12个月的随访中未发现肿瘤复发,因此均未考虑辅助治疗。组织病理学分析显示,所有样本均为WHO I级良性脑膜瘤,符合脑膜内皮型脑膜瘤亚型,MIB1增殖指数平均为1.1%。
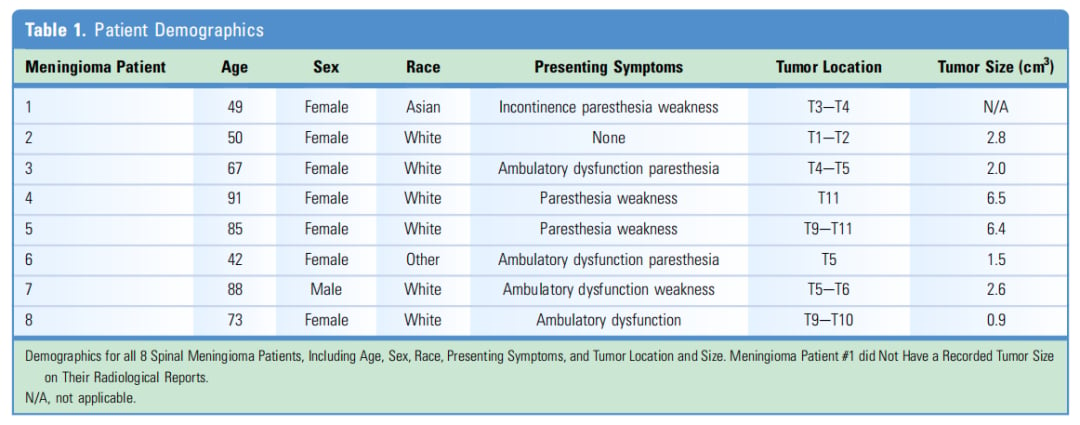
▲表1 人口统计学特征
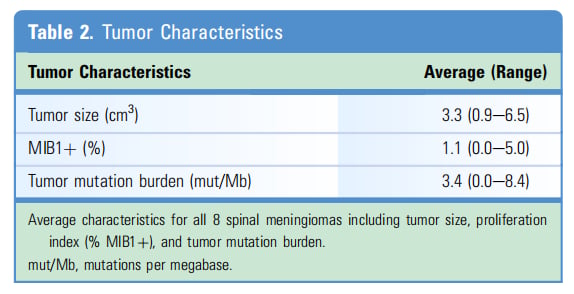
▲表2 肿瘤特征
基因组与表观遗传学分析结果
靶向基因测序结果显示,在脑膜瘤驱动突变中,NF2是最常见的突变基因,62.5%的患者存在截断突变。此外,1例患者携带激活型AKT1 E17K突变,且不伴有NF2突变。另有2例患者存在功能缺失型SMARCB1 R377H突变,其中1例与NF2突变共存。这些发现与先前研究一致,表明NF2突变型脊髓脑膜瘤更常见于胸椎,而AKT1E17K突变型脑膜瘤则多见于颈椎,尽管本研究中也发现1例胸段脊髓脑膜瘤携带AKT1 E17K突变,提示其分布并非完全排他。
除了已知的脑膜瘤驱动基因变异,研究还在调控Wnt/β-连环蛋白、Notch、MAPK/ERK和生长因子信号通路的基因中发现了临床意义不明的突变,进一步揭示了脊髓脑膜瘤遗传图谱的复杂性。所有样本的肿瘤突变负荷平均为每兆碱基3.4个突变。
DNA甲基化谱分析将5例样本归类为良性1型,1例为良性2型,2例为中间型A。尽管临床表现和组织病理学分级均显示为良性WHO I级脑膜瘤,但基因组和表观遗传学分析揭示了这些肿瘤在分子层面的显著多样性。


▲图1 脊髓脑膜瘤的基因组学、表观遗传学和临床综合分析
病例解析:SMARCB1突变型脊髓脑膜瘤
为了更直观地展示分子分析的临床意义,研究提供了一个具体病例。患者为一名42岁女性,因下背部疼痛、双侧下肢神经病理性疼痛及步态不稳数周就诊。磁共振成像显示T5水平椎管内存在硬膜内髓外实性肿块,导致胸髓严重受压。患者接受了手术切除,术后影像学未见残余肿瘤,症状显著改善,步态恢复至基线水平。
该病例的肿瘤活检组织病理学分类为WHO I级脑膜瘤,但其增殖性较高,5%的肿瘤细胞MIB1阳性表达,显著高于其他样本。遗传学分析显示存在SMARCB1基因R377H错义突变,肿瘤突变负荷为每兆碱基4.64个突变。DNA甲基化谱分析将该肿瘤归类为良性1型。这个病例强调了即使是WHO I级良性肿瘤,其分子特征也可能存在差异,提示了更深入分子分析的必要性。
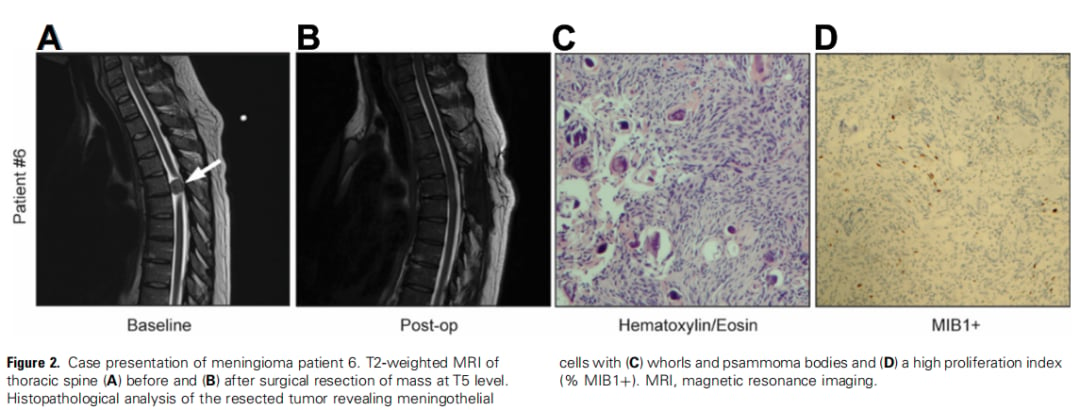
▲图2 病例6展示
分子分型对脊髓脑膜瘤诊疗的意义
随着对脊髓脑膜瘤分子特征理解的加深,其对临床诊疗的指导作用日益凸显。精准的分子分型不仅有助于预测肿瘤行为,更为靶向治疗策略的制定提供了依据。
精准分类与预后预测
本研究强调,尽管脊髓脑膜瘤的临床表现可能看似均一,但其基因组和表观遗传学图谱具有丰富的多样性。这种分子层面的多样性提示我们,传统的组织病理学分级可能不足以完全捕捉肿瘤的生物学复杂性。通过结合基因突变分析(如NF2、AKT1、SMARCB1)和DNA甲基化谱分析,可以实现对脊髓脑膜瘤更精准的分子分类。这种分子分型能够更好地预测肿瘤的侵袭性、复发风险以及对特定治疗的反应,从而为患者提供更个性化的预后评估和随访策略。
靶向治疗的探索与前景
在癌症治疗领域,靶向治疗已成为重要的发展方向,通过精确作用于肿瘤细胞特有的分子靶点,提高疗效并减少副作用。对于脑膜瘤,特别是携带特定基因突变的类型,靶向治疗的潜力正在被积极探索。
目前,多项早期临床试验正在研究和评估靶向治疗对NF2突变型脑膜瘤的疗效。例如,布格替尼(Brigatinib),一种间变性淋巴瘤激酶(ALK)抑制剂,已被证明可通过抑制多种酪氨酸激酶来减缓NF2突变型肿瘤的生长,目前正进行II期临床试验(NCT04374305)。同样,克唑替尼(Crizotinib),一种受体酪氨酸激酶抑制剂,也在NF2突变型肿瘤的治疗中展现出潜力,并有相关II期临床试验(NCT04283669)正在进行。此外,司美替尼(Selumetinib),作为一种MEK抑制剂,也正在进行II期临床试验(NCT03095248),以评估其在NF2突变型肿瘤管理中的有效性。
这些靶向药物的出现,为那些因肿瘤位置或大小无法完全手术切除,或术后复发风险较高的脊髓脑膜瘤患者带来了新的治疗希望。通过手术干预与靶向基因组治疗相结合的综合管理方法,有望为患者带来更好的临床结局。然而,这些策略在脊髓脑膜瘤中的应用仍需进一步的基因研究来推进和验证。
对于需要了解这些创新治疗方案或寻求海外用药选择的患者,AI辅助问诊服务可以提供个性化指导,帮助患者及其家属更好地理解复杂的医学信息和治疗路径。
脊髓脑膜瘤的挑战与未来方向
尽管本研究为我们理解胸段脊髓脑膜瘤的分子特征提供了宝贵数据,但仍存在一些挑战和未来的研究方向。
研究局限性与展望
本研究的样本量相对较小,且仅限于胸段脊髓脑膜瘤,这限制了其区分不同脊髓脑膜瘤群体(如颈椎与胸椎、NF2突变型与AKT1E17K突变型)的能力。未来的研究需要纳入更大规模、更具多样性的患者队列,以建立更清晰、更全面的脊髓脑膜瘤遗传和分子模式。此外,深入研究这些分子变异如何影响肿瘤的生长、侵袭性和对治疗的反应,将有助于开发更有效的个性化治疗策略。
获取创新药物的途径
随着靶向治疗药物的不断涌现,如何确保患者能够及时、便捷地获取这些创新药物成为一个重要议题。许多针对罕见基因突变或特定肿瘤类型的药物可能尚未在中国上市,或者价格昂贵,这给患者带来了不小的挑战。
MedFind致力于为癌症患者提供全球抗癌药品代购与国际直邮服务,确保患者能够及时获取所需药物,打破地域和审批的限制。同时,通过MedFind的药物信息与治疗方案解读,患者及其家属可以更全面地了解最新的研究进展和治疗选择,做出明智的医疗决策。
总结
本研究通过对胸段脊髓脑膜瘤的基因组和表观遗传学联合分析,揭示了NF2、AKT1、SMARCB1等关键驱动突变以及DNA甲基化谱的多样性。这些发现强调了分子分型在脊髓脑膜瘤精准诊断、预后评估和靶向治疗策略制定中的重要性。随着对这些分子机制理解的不断深入,结合布格替尼、克唑替尼等靶向药物的临床应用,我们有望为脊髓脑膜瘤患者带来更有效、更个性化的治疗方案,显著改善其临床结局和生活质量。