在与癌症的漫长斗争中,肿瘤的耐药性、复发和转移一直是摆在医学界面前的巨大挑战。尽管化疗和靶向治疗取得了显著进展,但癌细胞总能凭借其惊人的适应和演化能力,找到“逃生”路径。近年来,科学家们逐渐将目光聚焦于一种特殊的基因结构——染色体外DNA(ecDNA),它被认为是驱动肿瘤快速演化和恶性进展的关键“幕后推手”。
ecDNA,顾名思义,是存在于染色体之外的环状DNA片段。与线性染色体不同,ecDNA没有着丝粒,这使得它们在细胞分裂时无法像正常染色体那样被纺锤体精准牵引并平均分配到子细胞中。然而,令人费解的是,ecDNA却能在癌细胞世代中稳定地传递下去,甚至在药物压力下其数量还会显著增加,从而加速肿瘤的恶性进程。这一现象长期以来都是肿瘤生物学中一个悬而未决的谜题。
近期,一项发表在国际顶级期刊《自然》(Nature)上的突破性研究,由斯坦福大学等机构的科学家们共同完成,终于揭示了ecDNA如何在细胞分裂中“搭便车”的秘密。研究发现,癌细胞竟然“盗用”了维持细胞身份记忆的天然机制,为ecDNA打造了一套“永生”系统。这项发现不仅解开了ecDNA稳定传递的生物学谜题,更重要的是,它为开发全新的癌症治疗策略,特别是针对肿瘤耐药性问题,指明了新的方向。
ecDNA:癌细胞的“加速器”与“进化引擎”
要理解这项研究的意义,我们首先需要了解ecDNA究竟是什么以及它在癌症中的作用。ecDNA并非凭空产生,它们通常是染色体DNA在复制或修复过程中出错时,部分基因组片段断裂并重新连接形成的环状DNA分子。这些环状DNA中,只有那些携带着致癌基因(oncogene)和复制起始点的ecDNA,才会被癌细胞“选中”,成为推动肿瘤恶性进展的“加速器”。
大量研究表明,ecDNA在多种人类肿瘤中普遍存在,尤其是在高级别和侵袭性肿瘤中更为常见。据统计,约17.1%的肿瘤中含有ecDNA,并且在患者接受化疗或靶向治疗后,ecDNA的比例往往会明显上升。携带ecDNA的肿瘤通常表现出更强的侵袭性、更高的转移风险,以及更差的患者总体生存率。这表明ecDNA是肿瘤恶性生物学行为的重要驱动因素。
ecDNA之所以如此危险,在于其独特的环状结构和高拷贝数特性。它能够携带多个致癌基因,并通过高水平的基因扩增,使得癌细胞能够大量生产与肿瘤生长、增殖、耐药相关的蛋白质。更重要的是,ecDNA的不稳定性及其在细胞分裂中的不均衡分配,为癌细胞群体带来了巨大的遗传多样性,使其能够快速适应不断变化的微环境和药物压力,从而实现快速演化和耐药性的产生。
揭秘“搭便车”机制:滞留元件与细胞记忆
既然ecDNA没有着丝粒,按理说在细胞分裂时很容易丢失,那么它们是如何稳定地传递给子细胞的呢?这是困扰科学家多年的核心问题。传统的观点认为,没有着丝粒的DNA片段在细胞分裂时会被随机抛弃。然而,显微镜下却常常观察到ecDNA在细胞分裂期与染色体“亲密接触”,这暗示着它们一定存在某种特殊的“抓附”机制。
为了寻找这种神秘的“搭车”序列,斯坦福大学的研究团队开发了一项创新的筛选技术——Retain-seq。他们将人类基因组切碎成片段,插入到环状细菌DNA中,然后将这些重组DNA导入人类细胞,观察哪些序列能够让外源DNA在细胞世代中持续滞留。通过这项技术,研究人员从人类基因组中成功鉴定出超过1.4万个可能的“滞留元件”。
这些滞留元件具有显著的特征:它们大多富含CpG序列,并表现出启动子或增强子的特性,且通常处于低甲基化状态。低甲基化状态意味着这些区域的染色质结构相对开放,更容易与蛋白质结合,从而发挥其功能。进一步的研究揭示,在细胞分裂期,这些滞留元件会与染色体上特定的“有丝分裂书签”区域发生物理互作。所谓“有丝分裂书签”,是指少数在细胞分裂期仍保持活性的染色质区域,它们就像书签一样标记着细胞身份的关键基因,确保子细胞在分裂后能够“记住”自己的细胞类型和功能。
这项研究的精妙之处在于,它揭示了ecDNA正是模拟了启动子与增强子在健康细胞中与染色体互作的模式,只不过这种互作发生在不同的DNA分子之间。癌细胞巧妙地“盗用”了细胞原有的“记忆系统”,利用这些滞留元件与染色体上的有丝分裂书签结合,从而确保ecDNA在细胞分裂时不会被丢进细胞质的“垃圾场”,而是能够“搭上”染色体的“顺风车”,稳定地传递给子细胞。

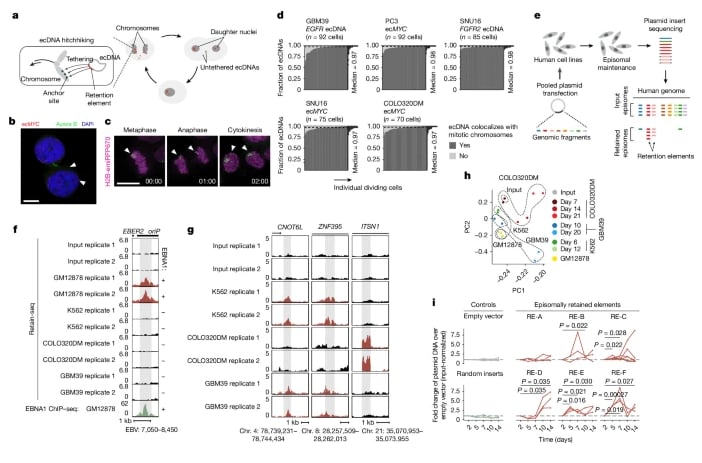
识别出促进附加体DNA保留的遗传元件
“基因彩票”效应:ecDNA如何加速肿瘤演化与耐药
尽管滞留元件确保了ecDNA的传递,但其与染色体的结合并非完全精准的均等分配。ecDNA在细胞分裂中的分配更像是一场“基因彩票”:有的子细胞可能继承了全部的ecDNA,有的可能只继承了一部分,而有的甚至可能一个都没有。这种不均衡的分配机制,虽然看起来有些“冒险”,却恰恰是肿瘤快速演化的强大引擎。
这种“基因彩票”效应使得癌细胞群体在短时间内积累了巨大的遗传多样性。当癌细胞面临化疗或靶向治疗等药物压力时,那些偶然继承了更多或特定ecDNA的子细胞,可能恰好携带了赋予其耐药性的致癌基因。这些“幸运”的癌细胞得以存活下来,并迅速增殖,最终导致肿瘤复发和治疗失败。这种快速适应环境、产生耐药性的能力,正是ecDNA驱动肿瘤恶性进展的关键所在。它解释了为何许多患者在初期对治疗反应良好,但很快就会出现耐药。
治疗新突破:靶向甲基化,让ecDNA“失手”
这项研究不仅揭示了ecDNA的“搭便车”机制,更重要的是,它发现了一个潜在的治疗突破口。研究人员发现,滞留元件的功能高度依赖于其低甲基化状态。这意味着,如果能够改变这些滞留元件的甲基化状态,就有可能干扰ecDNA与染色体的结合。
在实验室中,当研究人员对脑癌细胞ecDNA上的滞留元件进行靶向甲基化修饰后,这些ecDNA便失去了与染色体结合的能力,在细胞分裂中大量丢失。随着ecDNA的丢失,癌细胞上携带的致癌基因也随之减少,导致癌细胞的存活与增殖能力显著下降。这一发现强有力地证明了ecDNA的滞留并非随机黏附,而是一个高度特异的生物学过程,并且其“阿喀琉斯之踵”在于其甲基化状态。
这项研究为开发一类全新的癌症治疗策略提供了理论基础。如果我们能够设计出特异性靶向ecDNA滞留元件甲基化的药物,就有可能破坏ecDNA在癌细胞中的稳定传递,迫使癌细胞失去其最致命的进化武器。这对于克服肿瘤耐药性、提高治疗效果具有里程碑式的意义。对于癌症患者而言,了解这些前沿研究进展至关重要,因为它们预示着未来可能出现更精准、更有效的治疗方案。如果您希望了解更多前沿癌症治疗信息,请访问 MedFind 药物信息平台。
展望未来:从生物学谜题到精准治疗新纪元
这项发表在《自然》杂志上的研究,无疑为我们理解肿瘤异质性、耐药性演变和癌症治疗策略开辟了全新的视角。它不仅解开了ecDNA如何在细胞世代中持续传递的生物学谜题,更深层次地揭示了癌细胞如何“盗用”和改造细胞自身的天然机制,以实现其基因元件的“永生”。
滞留元件的发现,为未来的药物研发提供了明确的靶点。通过干扰ecDNA与染色体的互作界面,我们有望开发出能够特异性清除癌细胞中ecDNA的新型药物,从而从根本上削弱癌细胞的快速演化能力和耐药性。这可能代表着癌症治疗领域的一个重大突破,为那些对现有治疗方案产生耐药的患者带来新的希望。
随着科学研究的不断深入,我们对癌症的理解也越来越透彻。每一次对敌人“生存策略”的洞察,都可能成为我们扭转战局的关键。而这一次,科学家们在ecDNA的“搭车游戏”中找到了那个可能让整车失控的“刹车阀”。对于正在与癌症抗争的患者及其家属而言,及时获取最新的研究进展和治疗信息至关重要。如果您对个性化治疗方案有疑问,MedFind AI 辅助问诊服务可以提供初步参考。同时,对于需要获取海外创新药物的患者,MedFind 提供抗癌药品代购与国际直邮服务,帮助您及时获得所需的治疗选择。