胰腺癌:难以逾越的“癌王”挑战
胰腺导管腺癌(Pancreatic Ductal Adenocarcinoma, PDAC),因其极高的恶性程度和极低的治愈率,长期以来被冠以“癌王”的称号。据统计,全球范围内胰腺癌患者的总体五年生存率不足15%,这一数字凸显了其治疗的巨大挑战。胰腺癌的致命之处主要体现在两个方面:一是早期诊断极其困难,多数患者在确诊时已处于晚期,错失了最佳手术时机;二是对传统放疗和化疗药物(如顺铂、吉西他滨等)表现出高度耐受性,导致治疗效果不佳,容易复发。
传统放化疗药物通过诱导肿瘤细胞DNA损伤来发挥抗癌作用。然而,胰腺癌细胞却异常“聪明”,它们能够激活高效的DNA损伤修复通路,特别是同源重组(Homologous Recombination, HR)修复通路,来抵消这些损伤。这种强大的修复能力使得肿瘤细胞得以在治疗压力下存活并继续增殖,最终形成治疗抵抗,使患者陷入无药可用的困境。
最新研究突破:揭示胰腺癌耐药新机制
近日,一项由中国医学科学院肿瘤医院邓敏教授团队、刘芝华教授团队与美国梅奥医学中心Zhenkun Lou教授合作的重磅研究,在国际权威期刊《Cancer Research》上发表。这项研究首次深入揭示了胰腺癌抵抗放化疗的一个关键机制,并据此提出了极具潜力的治疗新策略,为攻克“癌王”带来了新的希望。

TGS1:胰腺癌恶性进展与治疗抵抗的关键因子
研究团队首先对TGS1蛋白在胰腺癌组织中的表达情况及其与临床预后的关系进行了详细分析。结果令人震惊:TGS1在胰腺癌肿瘤组织中呈现出显著的高表达,并且其表达水平与肿瘤的分期、对治疗的抵抗程度以及患者不良的预后密切相关。这表明TGS1不仅仅是胰腺癌发生发展过程中的一个旁观者,更是推动其恶性进展和治疗抵抗的关键驱动因素。值得注意的是,研究还发现TGS1的高表达与多种其他癌症类型(包括乳腺癌、宫颈癌、肾癌等)的不良预后也存在关联,提示TGS1可能在多种肿瘤中扮演着类似的重要角色。
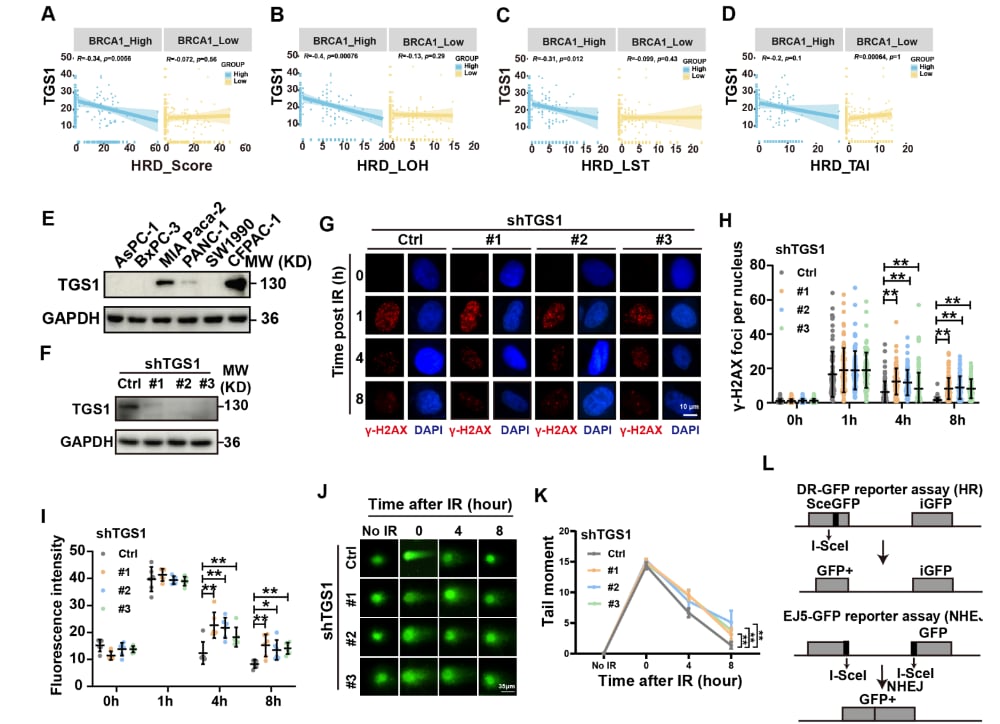
TGS1促进同源重组修复
ATM-TGS1-BRCA1轴:DNA损伤修复的“幕后推手”
为了深入理解TGS1在DNA损伤修复中的具体功能和作用机制,研究团队进行了一系列精密的体外(细胞系)和体内(细胞来源及患者来源的胰腺癌模型)实验。机制研究揭示了一个此前未知的信号轴:ATM-TGS1-BRCA1。当DNA发生损伤时,ATM激酶会被激活,并介导TGS1蛋白的丝氨酸残基S389和S531发生磷酸化。这一磷酸化修饰是关键一步,它促进了TGS1与著名的抑癌基因BRCA1的直接结合。随后,TGS1能够将BRCA1高效地招募到DNA损伤位点,从而显著增强同源重组(HR)修复的效率。
这一发现尤为令人意外,因为TGS1此前主要被认为是一种参与RNA修饰的甲基转移酶。本研究首次揭示了TGS1在DNA损伤修复中的全新功能,将其从一个“RNA修饰者”的角色拓展到了“DNA修复大师”的范畴,极大地丰富了我们对DNA损伤修复机制的理解。
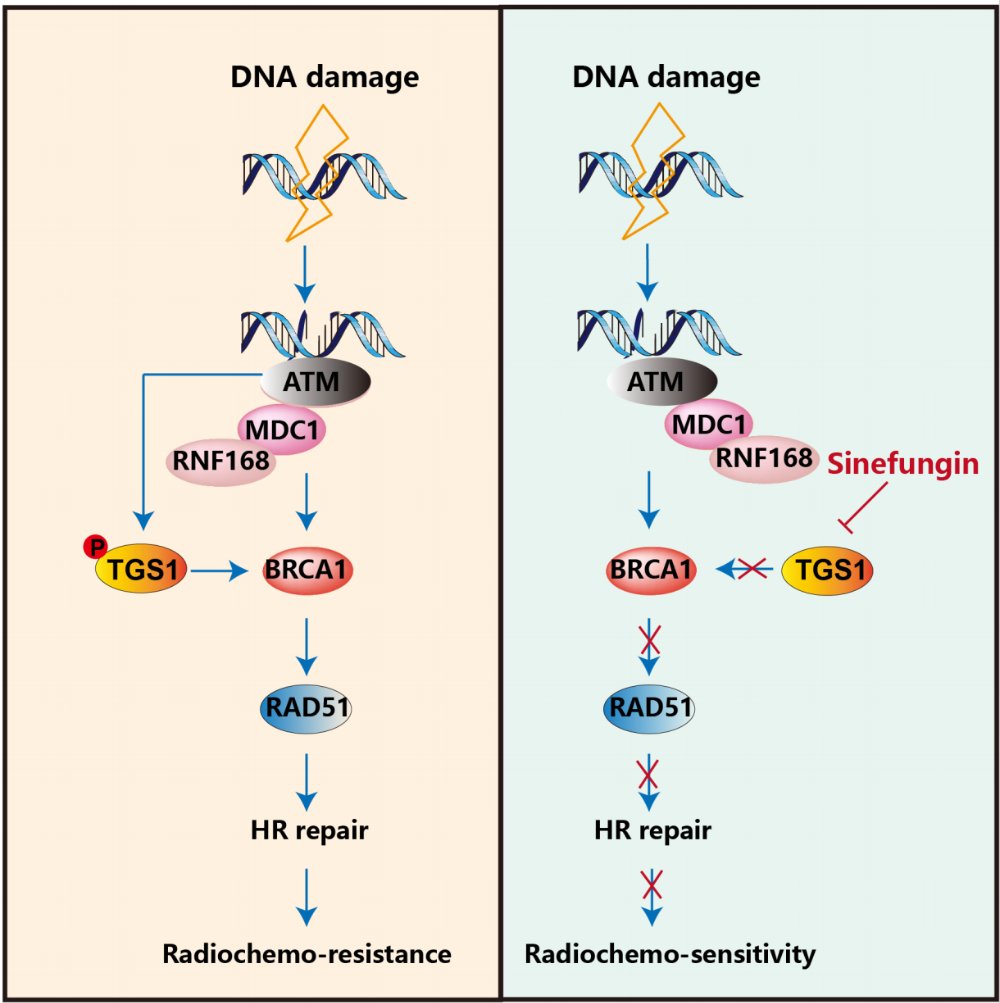
(左)DNA损伤后,ATM磷酸化TGS1(Ser389/Ser531),促进其与BRCA1结合并募集至DNA损伤位点以增强HR修复,导致放化疗耐受。(右)Sinefungin通过抑制TGS1表达削弱HR修复,从而提高胰腺癌对放化疗的敏感性。
靶向TGS1:克服胰腺癌耐药的新策略
既然TGS1在胰腺癌的治疗抵抗中扮演着如此重要的角色,那么抑制TGS1是否能逆转这种耐药性呢?研究结果给出了肯定的答案。实验表明,通过抑制或敲低TGS1的表达,可以显著阻断BRCA1向DNA损伤位点的募集,从而降低HR修复能力。这一干预措施使得胰腺癌细胞对放疗、顺铂以及PARP抑制剂的敏感性显著提高。
在胰腺癌小鼠模型中进行的体内实验进一步证实了这一策略的有效性。TGS1低表达的小鼠对顺铂或PARP抑制剂表现出更高的敏感性,肿瘤体积明显缩小,并且生存时间显著延长。这为靶向TGS1作为胰腺癌治疗的新方向提供了强有力的临床前依据。
Sinefungin与奥拉帕利:联合用药的协同效应
在寻找能够有效靶向TGS1的药物时,研究人员将目光投向了甲基转移酶抑制剂——Sinefungin。他们发现,Sinefungin能够有效降低TGS1蛋白的水平,从而模拟了TGS1敲低所产生的效应。更令人振奋的是,在多种胰腺癌模型中,Sinefungin与PARP抑制剂奥拉帕利(Olaparib)联合应用时,表现出显著的协同抗肿瘤效应。这意味着两种药物的联合使用,其抗癌效果远超单一药物,并且在实验中未观察到明显的毒性反应。
PARP抑制剂是一类靶向DNA损伤修复通路的药物,尤其对BRCA突变或HR缺陷的肿瘤具有显著疗效。而本研究发现TGS1通过ATM-TGS1-BRCA1轴增强HR修复,这为PARP抑制剂在胰腺癌中的应用提供了新的思路。通过Sinefungin抑制TGS1,可以“制造”出一种类似HR缺陷的状态,从而使胰腺癌对PARP抑制剂奥拉帕利更加敏感。这种联合用药的策略,有望为胰腺癌患者带来更有效、毒性更低的治疗选择。
展望未来:胰腺癌治疗的新希望
这项里程碑式的研究不仅首次揭示了ATM-TGS1-BRCA1信号轴在DNA损伤修复中的新功能,更重要的是,它为胰腺癌的治疗耐药机制提供了全新的理解。通过深入解析这一全新的耐药机制,研究团队提出了靶向TGS1以克服胰腺癌治疗耐药的新策略。特别是Sinefungin与PARP抑制剂奥拉帕利联合使用的方案,为改善胰腺癌治疗效果提供了切实可行的临床转化方向。
随着对“癌王”胰腺癌认识的不断深入,以及创新治疗策略的不断涌现,我们有理由相信,最终攻克这一顽疾的希望正在逐步变为现实。对于正在与胰腺癌抗争的患者及其家属而言,这项研究无疑带来了新的曙光和更广阔的治疗前景。了解更多抗癌药品代购与国际直邮服务,请访问 MedFind 药品商城,获取最新的药物信息和治疗方案解读,请关注 MedFind 资讯平台。
在医学研究的不断推进下,我们期待未来能有更多针对胰腺癌的精准治疗方案问世,帮助更多患者战胜病魔,重获健康。如需获取专业的AI辅助问诊服务,可尝试 MedFind AI 问诊,了解个性化的治疗建议和药物信息。





