在癌症治疗的漫长征途中,科学家们不断探索新的策略以期更精准、高效地打击肿瘤细胞,同时最大限度地保护正常组织。细胞周期蛋白D-CDK4/6-视网膜母细胞瘤(Rb)通路的异常激活,是多种人类癌症中驱动细胞不受控增殖和肿瘤进展的常见事件。针对这一关键通路,选择性CDK4/6抑制剂如帕博西尼(Palbociclib)的出现,为癌症治疗带来了革命性的变革。它通过阻滞细胞周期和诱导肿瘤细胞衰老,展现出显著的治疗潜力,且对正常组织毒性相对较小。然而,这类药物的主要作用是抑制细胞生长而非直接杀死细胞,这导致肿瘤清除不完全和容易产生治疗抵抗。此外,衰老细胞还会分泌衰老相关分泌表型(SASP)因子,反而可能促进肿瘤进展和免疫逃逸,为治疗带来新的挑战。
为了克服这些局限性,北京大学口腔医院王宇光主任医师、Zhang Ludan和Li Yike等研究人员合作,提出了一种名为“衰老启动的铁死亡”的创新策略。他们构建了一种基于金属有机框架(MOF)的纳米平台(ZPG),用于协同递送CDK4/6抑制剂帕博西尼和新型铁死亡诱导剂镓离子(Ga³⁺)。这项突破性研究不仅为口腔鳞状细胞癌(OSCC)等CDK4/6高活性肿瘤的治疗提供了新的思路,也为乳腺癌、脂肪肉瘤等其他CDK4/6驱动的恶性肿瘤带来了希望。相关研究成果以“Senescence-Primed Ferroptosis Enabled by a Metal–Organic Framework Nanoplatform for Enhanced Cancer Therapy”为题,发表在国际权威期刊《ACS Nano》上。
口腔鳞状细胞癌(OSCC):亟待突破的治疗困境
口腔鳞状细胞癌(OSCC)是头颈部最常见的恶性肿瘤之一,其发病率在全球范围内呈上升趋势。这种癌症以侵袭性强、易转移、标准治疗反应有限和预后差为主要特点。尽管手术、放疗和化疗是OSCC的标准治疗手段,但对于晚期或复发性患者,治疗效果往往不尽如人意,五年生存率较低。因此,开发新的、更有效的治疗策略对于改善OSCC患者的预后至关重要。OSCC中CDK4/6通路的异常高活化,使其成为评估CDK4/6靶向疗法新策略的理想模型。
“衰老启动铁死亡”:创新癌症治疗策略的核心理念
这项研究的核心在于“衰老启动的铁死亡”策略。要理解这一策略,我们首先需要了解两个关键的细胞生物学概念:细胞衰老(Senescence)和铁死亡(Ferroptosis)。
细胞衰老(Senescence):双刃剑效应
细胞衰老是一种细胞对各种应激(如DNA损伤、氧化应激、致癌基因激活)作出的反应,表现为细胞周期不可逆的停滞。在肿瘤发生早期,细胞衰老被认为是重要的肿瘤抑制机制,可以阻止受损细胞的无限增殖。然而,衰老细胞并非“死亡”细胞,它们仍然具有代谢活性,并会分泌一系列生物活性分子,统称为衰老相关分泌表型(SASP)。SASP因子包括细胞因子、趋化因子、生长因子和蛋白酶等,这些因子在某些情况下可能改变肿瘤微环境,促进炎症反应、血管生成,甚至诱导邻近细胞的恶性转化和免疫逃逸,从而成为肿瘤进展的“帮凶”。因此,如何利用衰老的肿瘤抑制作用,同时消除其潜在的促肿瘤效应,是癌症治疗领域面临的挑战。
铁死亡(Ferroptosis):一种新型的程序性细胞死亡
铁死亡是一种独特的程序性细胞死亡形式,其特征是铁依赖性的脂质过氧化累积。与传统的细胞凋亡(Apoptosis)不同,铁死亡不涉及半胱天冬酶的激活,而是通过细胞内活性氧(ROS)的生成、铁离子的积累以及脂质过氧化产物的堆积,最终导致细胞膜损伤和细胞死亡。近年来,铁死亡作为一种潜在的癌症治疗靶点受到了广泛关注,因为许多癌细胞对铁死亡表现出高度敏感性,并且诱导铁死亡可以克服一些传统化疗和靶向治疗的耐药性。
ZPG纳米平台:帕博西尼与Ga³⁺的协同递送
为了实现“衰老启动的铁死亡”策略,研究团队精心设计并合成了一种基于ZIF-67金属有机框架(MOF)的纳米平台——ZPG。MOF材料因其高孔隙率、可调谐的结构和良好的生物相容性,在药物递送领域展现出巨大潜力。ZPG纳米平台能够同时负载CDK4/6抑制剂帕博西尼和铁死亡诱导剂Ga³⁺,并具有以下关键特性:
- 良好的生理稳定性: 确保纳米颗粒在体内循环过程中保持完整性,有效抵达肿瘤部位。
- 改善的细胞摄取: 纳米尺寸和表面特性有助于肿瘤细胞高效内吞ZPG。
- 控制性药物释放: ZPG在生理pH下稳定,但在酸性溶酶体环境中能实现pH响应性的药物快速释放,确保药物在肿瘤细胞内高效作用。


示意图1. 用于通过衰老启动铁死亡实现选择性增强癌症治疗的ZPG“纳米净化器” (a) 设计和合成用于癌症治疗的ZPG纳米颗粒示意图。(b) ZPG通过阻断CDK4/6介导的细胞周期进程诱导衰老,从而使肿瘤细胞对Ga³⁺诱导的铁死亡敏感。这种衰老启动的铁死亡策略能够选择性消除具有CDK4/6高活性的肿瘤细胞,同时最大限度地减少对正常细胞的脱靶毒性。
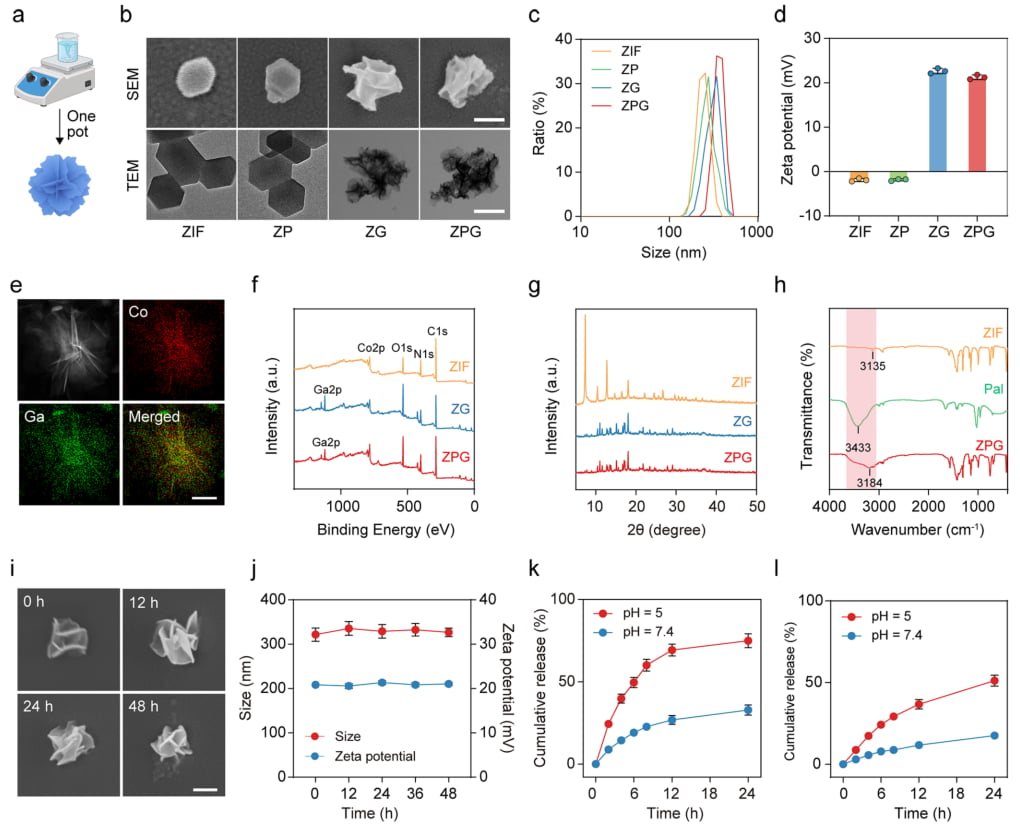
图1. ZIF、ZP、ZG和ZPG纳米颗粒的合成与表征 (a) ZIF、ZP、ZG和ZPG纳米颗粒的合成示意图。(b) ZIF、ZP、ZG和ZPG纳米颗粒的透射电镜图像。(c) ZIF、ZP、ZG和ZPG纳米颗粒的粒径分布。(d) ZIF、ZP、ZG和ZPG纳米颗粒的能谱元素分布图(Co, Ga)及合并图像。(e) ZPG纳米颗粒的高角度环形暗场扫描透射电镜图像及相应元素分布图。(f) ZIF、ZG和ZPG的X射线光电子能谱全谱图。(g) ZIF、ZP、ZG和ZPG的X射线衍射图谱。(h) ZIF、ZP、ZG、ZPG和游离帕博西尼的傅里叶变换红外光谱图。(i) ZPG纳米颗粒在pH 7.4的磷酸盐缓冲液中孵育不同时间后的透射电镜图像。(j) ZPG纳米颗粒在pH 7.4条件下孵育不同时间后的粒径和zeta电位变化。(k) ZPG纳米颗粒在不同pH缓冲液中帕博西尼的累积释放曲线。(l) ZPG纳米颗粒在不同pH缓冲液中Ga³⁺的累积释放曲线。
帕博西尼(Palbociclib):CDK4/6抑制剂的机制与应用
帕博西尼是一种口服的细胞周期蛋白依赖性激酶4和6(CDK4/6)抑制剂。CDK4/6在细胞周期G1期向S期的转变中发挥关键作用,其过度活化是许多肿瘤细胞增殖的驱动因素。通过抑制CDK4/6,帕博西尼能够有效阻滞癌细胞的细胞周期,使其停滞在G1期,从而抑制肿瘤生长。帕博西尼已获批用于治疗激素受体阳性(HR+)、人表皮生长因子受体2阴性(HER2-)的晚期或转移性乳腺癌,并显著改善了患者的无进展生存期。然而,如前所述,其诱导的细胞衰老虽然能抑制增殖,但并不能直接杀死所有癌细胞,且可能通过SASP因子促进肿瘤微环境的恶化,导致治疗抵抗和肿瘤复发。
对于帕博西尼这类创新靶向药物,患者可以通过MedFind平台了解其海外购买渠道和国际直邮服务,获取最新的用药信息,确保及时用药。
Ga³⁺:铁死亡诱导剂的独特作用
镓离子(Ga³⁺)作为一种铁死亡诱导剂,其作用机制独特。在生物体内,Ga³⁺能够模拟三价铁离子(Fe³⁺)与蛋白质结合,从而干扰细胞正常的铁代谢过程。铁是许多酶(包括参与DNA合成和能量代谢的酶)的必需辅因子,也是活性氧生成的重要催化剂。通过扰乱铁稳态,Ga³⁺能够促进细胞内活性氧的积累和脂质过氧化,进而诱导癌细胞发生铁死亡。将Ga³⁺与帕博西尼结合,旨在利用帕博西尼诱导的衰老状态,使癌细胞对Ga³⁺诱导的铁死亡更加敏感,从而实现更彻底的肿瘤清除。
体外实验验证:ZPG的肿瘤选择性与协同效应
研究人员在体外对ZPG纳米平台的抗肿瘤活性进行了全面评估。结果显示,ZPG在CDK4/6高活性的OSCC细胞(MOC-1)中表现出优异的细胞摄取和最强的细胞毒性。更重要的是,ZPG对正常成纤维细胞(L929)的毒性显著更低,充分体现了其卓越的肿瘤选择性杀伤能力。这种选择性是实现精准治疗、减少副作用的关键。
高效诱导衰老:增强癌细胞敏感性
实验证实,ZPG处理能够高效诱导MOC-1细胞衰老。具体表现为:
- 细胞周期阻滞: MOC-1细胞G0/G1期阻滞比例大幅增加,表明细胞增殖受到有效抑制。
- 衰老标志物上调: 衰老标志物SA-β-半乳糖苷酶活性和p16INK4a蛋白表达显著上升,这是细胞进入衰老状态的典型特征。
- SASP因子分泌: 虽然SASP因子分泌增多,但后续的铁死亡诱导策略旨在清除这些衰老细胞,从而避免SASP的负面效应。
在正常L929细胞中,这些衰老指标变化甚微,进一步印证了ZPG的肿瘤选择性。重要的是,这种由帕博西尼诱导的衰老状态,导致了癌细胞内抗铁死亡因子(如谷胱甘肽过氧化物酶4, GPX4和谷胱甘肽, GSH)的下调,以及促铁死亡因子(如长链脂肪酰辅酶A合成酶4, ACSL4和二价铁离子, Fe²⁺)的上调。这种分子层面的重编程,削弱了癌细胞的抗氧化防御能力,促进了脂质过氧化,从而使衰老细胞对铁死亡变得高度敏感。
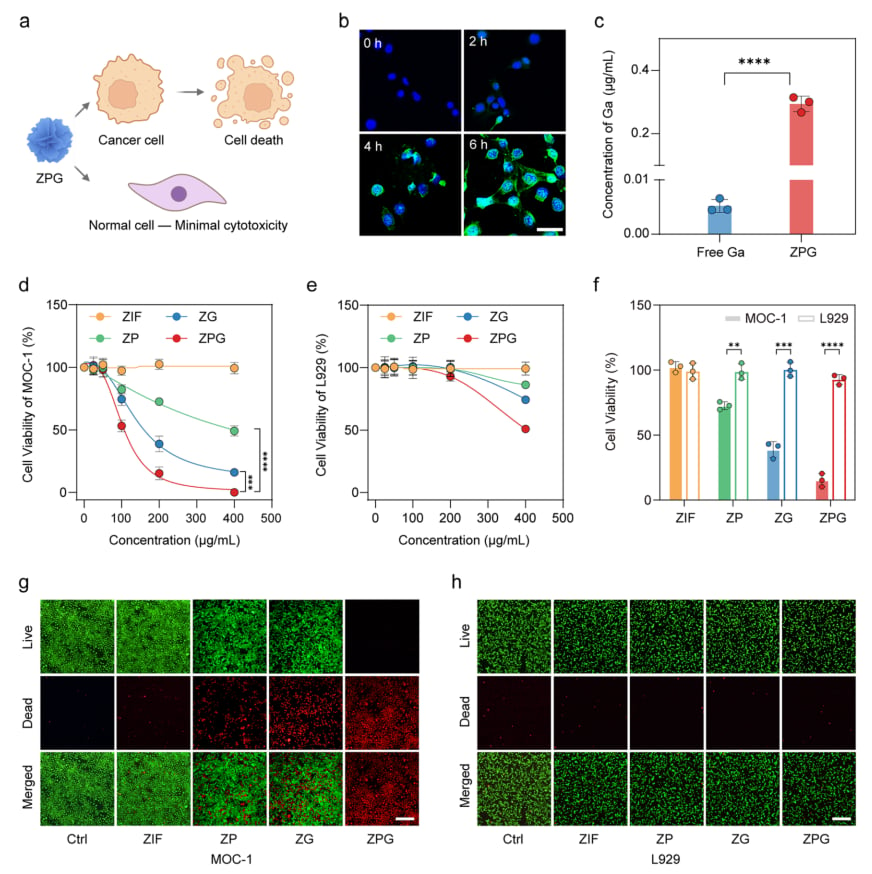
图2. ZPG在OSCC细胞中的选择性及强效抗肿瘤活性 (a) ZPG介导的帕博西尼和Ga³⁺协同增强癌细胞细胞毒性示意图。(b) MOC-1细胞与FITC标记的ZPG孵育不同时间后的共聚焦荧光图像。(c) 通过ICP-MS测定的MOC-1细胞对ZPG或游离Ga³⁺的摄取量。(d) 用不同浓度的ZIF、ZP、ZG和ZPG处理MOC-1细胞12小时后的细胞活力(CCK-8法)。(e) 用不同浓度的ZIF、ZP、ZG和ZPG处理L929细胞12小时后的细胞活力。(f) 在200 μg/mL纳米颗粒浓度下,MOC-1和L929细胞的细胞活力对比。(g, h) 用不同纳米颗粒(200 μg/mL)处理12小时后,MOC-1细胞 (g) 和L929细胞 (h) 的活细胞(绿色,Calcein-AM染色)/死细胞(红色,碘化丙啶染色)荧光图像。
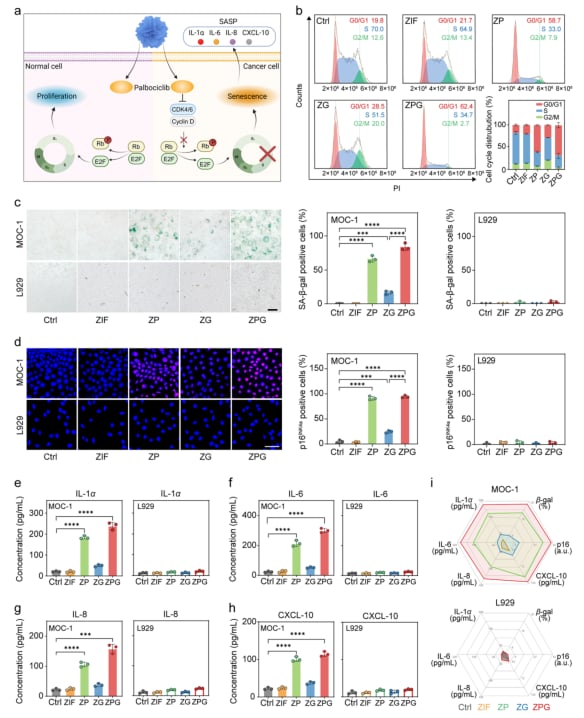
图3. ZIF基制剂诱导衰老的体外评价 (a) ZPG选择性诱导CDK4/6高活性肿瘤细胞衰老示意图。(b) 不同制剂处理后MOC-1细胞周期的流式细胞术分析。(c) 不同制剂处理后MOC-1和L929细胞的代表性SA-β-半乳糖苷酶染色图像及阳性细胞定量分析。(d) 不同制剂处理后MOC-1和L929细胞的代表性p16INK4a免疫荧光图像及阳性细胞定量分析。(e-h) MOC-1和L929细胞中SASP因子(包括IL-1α (e)、IL-6 (f)、IL-8 (g) 和CXCL-10 (h))的定量分析。(i) 总结MOC-1和L929细胞中衰老相关标志物水平的雷达图。
显著促进铁死亡:彻底清除癌细胞
在衰老启动的基础上,Ga³⁺的递送进一步放大了铁死亡应激。与仅负载单一组分的纳米颗粒相比,ZPG引起了最显著的铁死亡表型:
- 铁离子和活性氧积累: 细胞内Fe²⁺和活性氧(ROS)积累大幅增加,这是铁死亡的关键驱动因素。
- 线粒体功能障碍: 线粒体膜电位下降,表明线粒体功能受损,进一步促进细胞死亡。
- 谷胱甘肽耗竭与脂质过氧化: 谷胱甘肽(GSH)是细胞内重要的抗氧化剂,其耗竭导致细胞失去抵抗氧化应激的能力;脂质过氧化水平升高是铁死亡的标志性事件。
- 乳酸脱氢酶释放: 细胞膜损伤导致乳酸脱氢酶(LDH)释放增多,是细胞死亡的直接证据。
分子生物学分析进一步支持了这一机制。Western blot分析显示,ZPG能够协同下调关键抗铁死亡蛋白GPX4的表达,并上调促铁死亡蛋白ACSL4的表达,从分子水平上促进了铁死亡进程。RNA测序分析(RNA-seq)从全局基因表达层面证实,ZPG处理激活了细胞衰老和铁死亡相关通路,为“衰老启动的铁死亡”策略提供了坚实的分子证据。
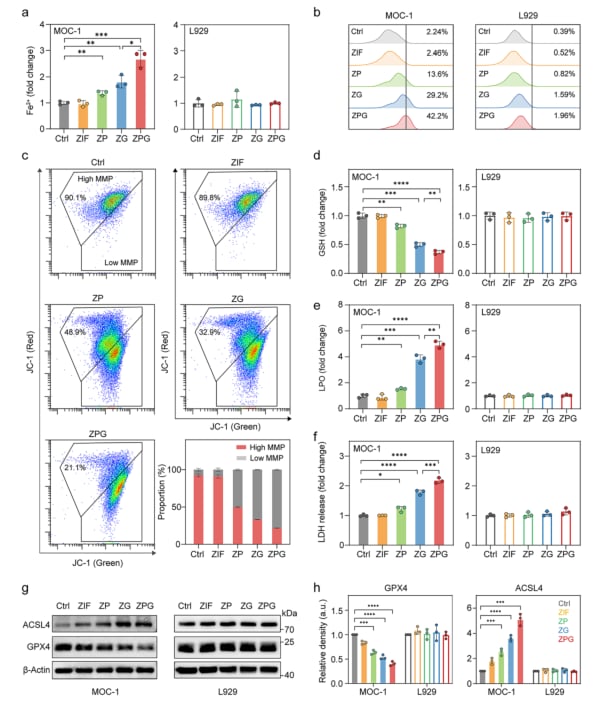
图4. ZIF基制剂诱导铁死亡的体外评价 (a) 不同纳米颗粒处理后MOC-1和L929细胞内的Fe²⁺积累。(b) 不同制剂处理后MOC-1和L929细胞内活性氧生成的流式细胞术分析。(c) 不同制剂处理后MOC-1细胞线粒体膜电位的流式细胞术分析。(d) 不同纳米颗粒处理后MOC-1和L929细胞的细胞内GSH水平分析。(e) 不同纳米颗粒处理后MOC-1和L929细胞的LPO水平分析。(f) 不同纳米颗粒处理后MOC-1和L929细胞的LDH释放。(g, h) 不同制剂处理后MOC-1和L929细胞中GPX4和ACSL4表达的Western blot分析 (g) 及密度定量分析 (h)。
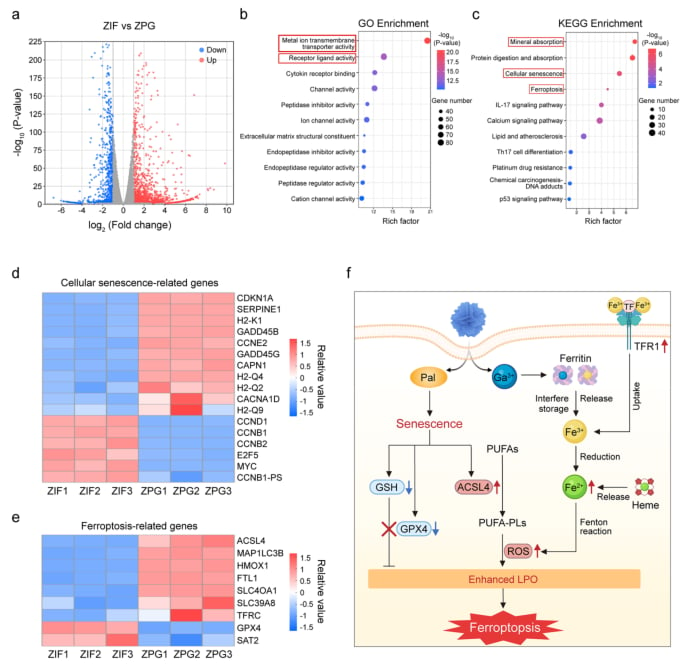
图5. ZPG在MOC-1细胞中抗肿瘤作用的RNA测序分析及机制图 (a) ZIF处理和ZPG处理的MOC-1细胞之间差异表达基因的火山图。(b) 差异表达基因的基因本体富集分析。(c) 京都基因与基因组百科全书通路富集分析。与铁死亡、细胞衰老和矿物质吸收相关的通路被高亮显示。(d) 衰老相关基因的热图。(e) 铁死亡相关基因的热图。(f) ZPG诱导衰老启动铁死亡并协同增强抗肿瘤功效的分子机制示意图。
体内抗肿瘤功效:小鼠模型中的突破性表现
为了进一步验证ZPG的治疗潜力,研究人员在MOC-1细胞构建的皮下移植瘤小鼠模型中进行了体内实验。荧光成像结果显示,静脉注射ZPG后,纳米颗粒能够有效富集于肿瘤部位,这对于实现精准靶向治疗至关重要。治疗结果令人鼓舞:
- 肿瘤生长显著抑制: ZPG治疗组的肿瘤生长受到最显著的抑制,肿瘤重量最小,表明其强大的抗肿瘤功效。
- 系统性毒性低: 治疗期间小鼠体重保持稳定,未出现明显的体重下降,这预示着ZPG具有较低的系统性毒性,提高了治疗的安全性。
- 病理学证据: 肿瘤组织病理学分析显示,ZPG治疗组出现大片坏死区域,证实了肿瘤细胞被有效清除。同时,衰老标志物p16INK4a表达上调,增殖标志物Ki67和抗铁死亡蛋白GPX4表达被强烈抑制,从组织学层面验证了衰老启动的铁死亡机制在体内的有效性。
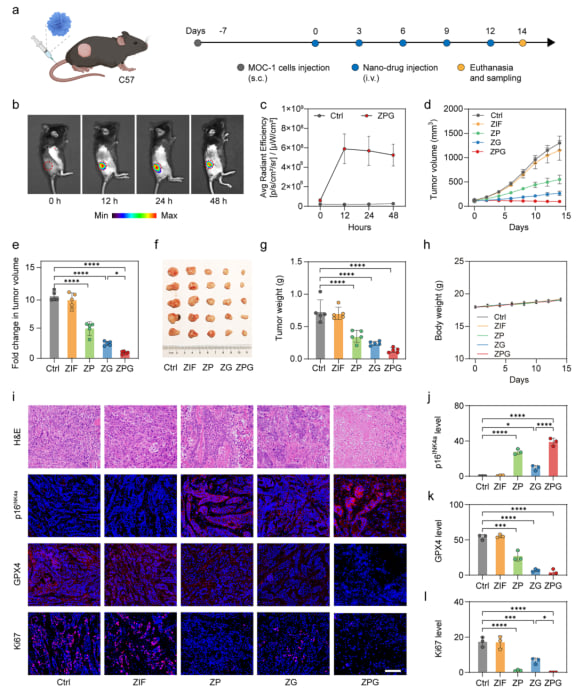
图6. ZPG纳米颗粒的体内抗肿瘤功效 (a) 肿瘤建立、治疗和样本收集的实验时间线示意图。(b) 静脉注射Cy5.5标记的ZPG后不同时间点荷瘤小鼠的荧光图像。(c) Cy5.5标记的ZPG在MOC-1荷瘤小鼠肿瘤中的积累情况。(d) 对照组、ZIF组、ZP组、ZG组和ZPG组的肿瘤生长曲线。(e) 各组肿瘤体积的倍数变化(第14天肿瘤体积与第0天的比值)。(f) 各组剥离的肿瘤照片。(g) 各组的最终肿瘤重量。(h) 治疗期间小鼠的体重变化。(i) 各组肿瘤组织的H&E染色以及p16INK4a、GPX4和Ki67的免疫荧光染色。(j-l) 肿瘤组织中p16INK4a (j)、GPX4 (k) 和Ki67 (l) 表达的定量分析。
了解更多关于口腔鳞状细胞癌的治疗方案和前沿研究,以及其他癌症的最新进展,患者和家属可以访问MedFind药物信息、治疗方案解读与临床研究资讯专区,获取权威、专业的医学信息。
展望与挑战:从实验室到临床的转化之路
这项研究成功开发了一种基于ZIF-67 MOF的“纳米净化器”ZPG,通过协同递送帕博西尼和Ga³⁺,巧妙地实现了“衰老启动的铁死亡”治疗策略。该策略能够选择性地诱导CDK4/6高活性肿瘤细胞衰老,进而敏化并促使它们发生铁死亡,在显著增强抗肿瘤疗效的同时,最大限度地保护了正常细胞,展现出极高的治疗窗口。
这一创新策略不仅为口腔鳞状细胞癌等CDK4/6驱动的恶性肿瘤(如乳腺癌、脂肪肉瘤)提供了充满希望的新治疗思路,也为克服传统CDK4/6抑制剂的耐药性和副作用提供了潜在解决方案。然而,从实验室研究到临床应用的转化仍面临诸多挑战,包括:
- 大规模纳米药物生产: 确保ZPG纳米颗粒的稳定、高效、经济的大规模生产,以满足临床需求。
- 长期生物安全性评价: 尽管小鼠模型显示毒性较低,但在人体内的长期生物安全性、免疫原性及代谢途径仍需进行严格、全面的评估。
- 患者分层与生物标志物: 识别能够从该疗法中获益最大的患者群体,开发有效的生物标志物以指导临床用药和疗效监测。
- 临床试验: 开展严格的I、II、III期临床试验,以验证其在人体内的安全性、有效性和最佳剂量。
尽管挑战重重,但本研究确立的“衰老启动铁死亡”策略,无疑为改善CDK4/6信号过度活化肿瘤的治疗带来了充满希望的新方向。随着纳米医学和肿瘤生物学研究的不断深入,我们有理由相信,这类创新疗法将最终惠及广大癌症患者。
对于这类创新疗法,患者可能需要获取海外已上市的帕博西尼等药物。MedFind提供便捷的抗癌药品代购与国际直邮服务,确保患者及时用药,不错过任何治疗机会。同时,如果您对癌症治疗方案有任何疑问,欢迎使用MedFind AI辅助问诊服务,获取个性化的专业建议。