胶质母细胞瘤(GBM),作为成人中最常见且最具侵袭性的原发性脑肿瘤,其治疗一直面临着巨大的挑战。这种高度恶性的肿瘤以其快速生长、浸润性强、对传统治疗(如手术、放疗和化疗)抵抗性高以及预后极差而闻名。尽管医学界在诊断和治疗方面取得了进步,但GBM患者的五年生存率仍然非常低,中位生存期通常不足两年。其复杂的肿瘤微环境、高度的肿瘤异质性以及血脑屏障的存在,都极大地限制了现有治疗手段的疗效,尤其是免疫治疗,在GBM中的效果往往不尽如人意。
近年来,细胞生物学领域的一个新兴概念——液-液相分离(Liquid-Liquid Phase Separation, LLPS),逐渐进入了肿瘤研究者的视野。LLPS是一种重要的细胞调控机制,它允许细胞内的生物大分子(如蛋白质和核酸)在特定条件下自发地形成无膜的生物分子凝聚物,这些凝聚物在细胞的多种生理过程中发挥着关键作用,包括基因表达调控、信号转导、应激反应等。越来越多的证据表明,LLPS的异常与多种疾病的发生发展密切相关,尤其是在肿瘤的发生、发展、转移以及治疗抵抗中扮演着日益重要的角色。
然而,LLPS相关基因在胶质母细胞瘤中的具体作用机制、其对肿瘤免疫微环境的影响以及潜在的临床价值,此前尚未得到系统而全面的阐明。为了填补这一研究空白,来自首都医科大学的Chun Zeng教授和Fusheng Liu教授团队开展了一项开创性的研究。他们通过多组学整合分析与严谨的实验验证,深入揭示了LLPS相关基因在GBM免疫调控、预后分层以及化疗抵抗中的核心作用,并成功构建了一个具有高度临床应用潜力的预后模型。这项研究的成果不仅为我们理解GBM的复杂生物学机制提供了新的视角,也为开发更有效的诊断工具和治疗策略指明了方向。
胶质母细胞瘤:一种难以攻克的脑部恶性肿瘤
胶质母细胞瘤(GBM)是成人最常见的原发性恶性脑肿瘤,约占所有原发性脑肿瘤的45%。它起源于大脑或脊髓的星形胶质细胞,以其高度的侵袭性、快速的细胞增殖、广泛的血管生成以及对周围脑组织的浸润性生长为特征。GBM的恶性程度极高,世界卫生组织(WHO)将其分类为IV级肿瘤。
GBM的治疗困境与挑战
尽管现代医学在手术、放疗和化疗方面取得了显著进展,但GBM的治疗效果仍然不尽如人意。标准的治疗方案通常包括最大限度地安全切除肿瘤、术后同步放化疗(替莫唑胺)以及后续的替莫唑胺辅助化疗。然而,由于以下几个核心挑战,GBM的治疗效果受到严重限制:
- 肿瘤异质性: GBM肿瘤内部存在高度的细胞异质性,不同区域的肿瘤细胞可能具有不同的基因突变、信号通路激活模式和对治疗的反应。这种异质性使得单一治疗方案难以彻底清除所有肿瘤细胞。
- 血脑屏障: 血脑屏障是保护大脑免受有害物质侵害的生理屏障,但同时也阻碍了许多化疗药物和靶向药物进入肿瘤区域,降低了药物的有效浓度。
- 肿瘤微环境: GBM的肿瘤微环境是一个复杂的生态系统,包含肿瘤细胞、免疫细胞(如巨噬细胞、小胶质细胞)、血管内皮细胞和间充质细胞等。这个微环境通过分泌细胞因子、生长因子和免疫抑制分子,促进肿瘤生长、血管生成和免疫逃逸。
- 治疗抵抗: GBM细胞常常发展出对化疗和放疗的抵抗机制,例如DNA损伤修复能力的增强、细胞凋亡通路的抑制以及干细胞样特性,导致治疗失败和肿瘤复发。
- 免疫抑制: GBM的肿瘤微环境具有强烈的免疫抑制特性,抑制T细胞的活化和功能,使得免疫检查点抑制剂等免疫治疗在GBM中的疗效远不如在其他实体瘤中显著。
这些挑战共同导致了GBM患者预后不良,迫切需要新的治疗策略和生物标志物来指导精准治疗。
液-液相分离(LLPS)与肿瘤生物学:新兴的调控机制
液-液相分离(LLPS)是细胞内一种普遍存在的物理化学过程,它允许细胞内的生物大分子(主要是蛋白质和核酸)在特定条件下,通过弱相互作用(如π-π堆叠、疏水相互作用、静电相互作用等)自发地从细胞质或细胞核的均相溶液中分离出来,形成高浓度、无膜的液滴状凝聚物。这些凝聚物被称为生物分子凝聚物或相分离体,它们具有液态特性,能够快速形成和溶解,并允许内部组分进行动态交换。
LLPS的生理功能与肿瘤关联
在正常的生理条件下,LLPS在细胞内发挥着多种关键功能,包括:
- 基因表达调控: 参与转录、剪接、翻译等过程,例如形成转录因子凝聚物、剪接体等。
- 信号转导: 促进信号分子在特定时间和空间内聚集,提高信号传导效率。
- 应激反应: 在细胞面临应激时(如热休克、氧化应激),形成应激颗粒,保护细胞免受损伤。
- 细胞器组装: 参与核仁、P-小体等无膜细胞器的形成。
然而,当LLPS的调控机制出现异常时,它可能成为疾病发生发展的重要驱动因素,尤其是在癌症中。LLPS的失调可以通过多种途径促进肿瘤的发生发展:
- 促进肿瘤细胞增殖: 异常的LLPS可能导致癌基因的过度表达或抑癌基因的失活,从而驱动细胞无限增殖。
- 增强肿瘤细胞存活: 帮助肿瘤细胞抵抗凋亡,增强其在恶劣微环境下的生存能力。
- 促进肿瘤转移: 影响细胞骨架重塑和细胞迁移能力,从而促进肿瘤细胞的侵袭和转移。
- 介导药物抵抗: 形成药物抵抗相关的蛋白质凝聚物,将药物泵出细胞或隔离药物靶点,从而降低化疗药物的疗效。
- 影响肿瘤免疫微环境: 调控免疫细胞的功能和状态,促进免疫抑制性微环境的形成,帮助肿瘤逃避免疫监视。
鉴于LLPS在肿瘤生物学中的多重作用,深入研究其在特定肿瘤类型(如胶质母细胞瘤)中的调控机制和临床意义,对于开发新的诊断生物标志物和治疗靶点具有重要的战略意义。
首都医科大学团队的突破性研究:揭示GBM中LLPS基因图谱
面对胶质母细胞瘤的治疗困境以及LLPS在肿瘤中日益凸显的重要性,首都医科大学的Chun Zeng教授和Fusheng Liu教授团队开展了一项深入研究。他们的研究旨在系统性地阐明LLPS相关基因在GBM中的作用机制、对免疫微环境的影响、预后价值以及与化疗抵抗的关系。
这项研究的独特之处在于其整合了多组学数据分析与严谨的实验验证,构建了一个全面的“作用图谱”,为理解GBM的复杂生物学机制提供了新的视角,并为开发更有效的诊断工具和治疗策略奠定了基础。
研究方法解析:深度挖掘LLPS相关基因
该研究采用了多层次、多维度的综合分析策略,以确保研究结果的全面性和可靠性:
- 数据筛选与基因鉴定: 研究团队首先基于GSE4290数据集,筛选出在GBM中差异表达的LLPS相关基因(DELRGs)。随后,通过构建蛋白互作网络,鉴定出在这些DELRGs中发挥核心作用的关键基因。
- 分子亚型聚类: 对143例GBM患者样本的DELRGs表达谱进行聚类分析,旨在识别具有不同生物学特征和临床预后的分子亚型。
- 单细胞数据评估: 利用单细胞RNA测序数据,评估LLPS活性在GBM肿瘤微环境中不同细胞类型中的分布情况,以揭示LLPS在细胞层面的精细调控。
- 预后风险模型构建与验证: 采用Cox回归分析和stepAIC(逐步回归法)方法,构建了一个基于关键DELRGs的风险评分模型。该模型在TCGA(癌症基因组图谱)队列中进行初步构建,并在REMBRANDT、CGGA325和CGGA693等三个独立的外部队列中进行了严格的验证,以确保其稳定性和普适性。
- 免疫微环境特征分析: 结合7种不同的免疫算法,对高低风险组的免疫微环境特征进行深入分析,包括免疫细胞浸润、免疫检查点表达以及炎症反应等,以揭示LLPS相关基因对GBM免疫逃逸的潜在影响。
- 药物敏感性评估: 整合药物敏感性数据,评估不同风险组对常用化疗药物的耐药性,特别是对顺铂(Cisplatin)和索拉非尼(Sorafenib)等药物的反应差异,为临床用药提供指导。
- 调控网络构建: 构建了转录因子-miRNA调控网络,以深入理解LLPS相关基因表达的调控机制。
- 实验验证: 通过qRT-PCR技术,在胶质瘤细胞系中对关键基因的表达进行实验验证,以支持生物信息学分析的结果。
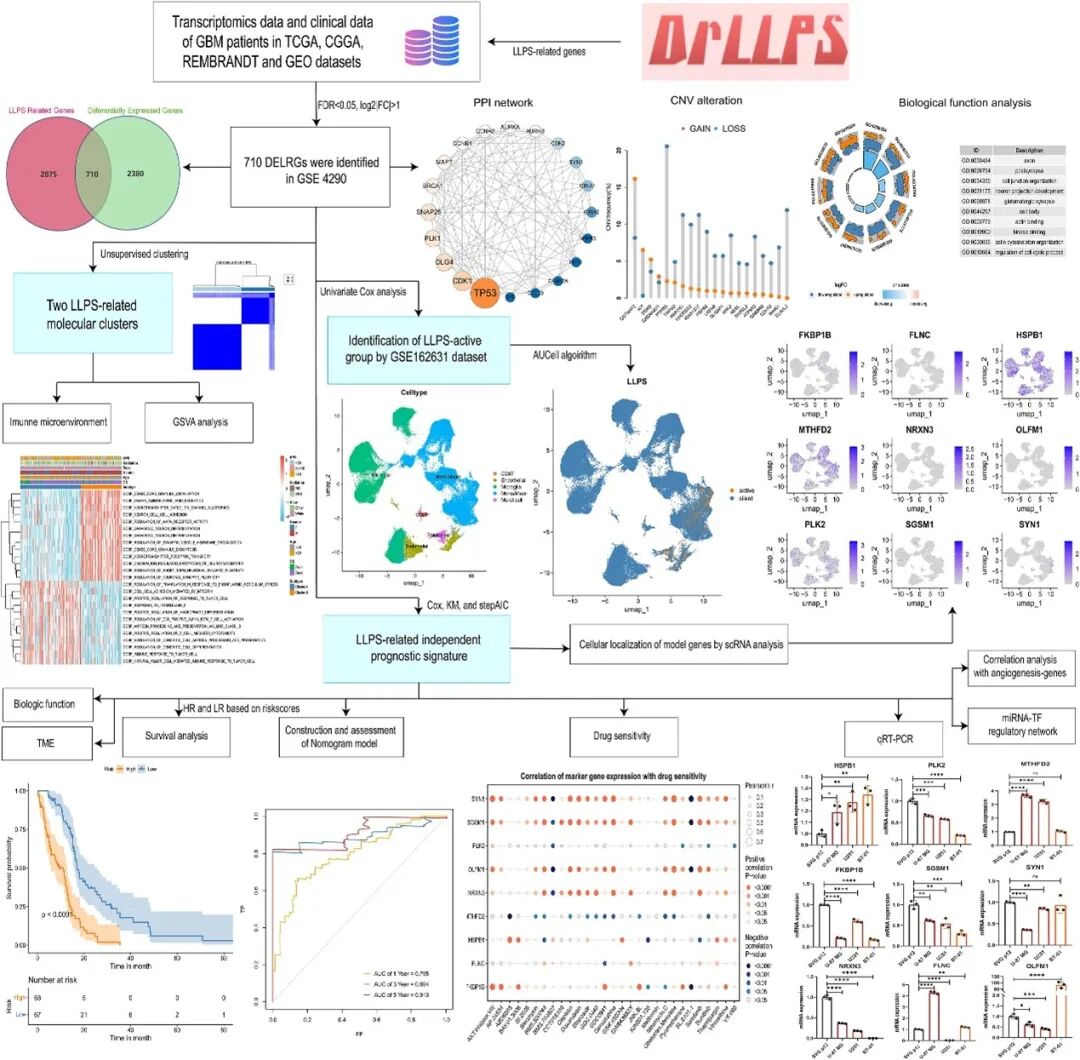
图1 基于液-液相分离相关基因的GBM患者转录组、临床及单细胞RNA测序数据的综合分析流程
核心发现:LLPS基因图谱揭示GBM新特征
这项深入研究取得了多项关键发现,为理解胶质母细胞瘤的生物学特性和寻找新的治疗靶点提供了宝贵线索:
DELRGs的识别与功能富集
研究团队首先鉴定了710个在GBM中差异表达的液-液相分离相关基因(DELRGs)。通过构建蛋白质互作网络,他们发现其中TP53、CDK1等5个基因处于网络的核心位置,提示它们在LLPS调控网络中可能扮演着关键角色。功能富集分析显示,这些DELRGs主要参与突触结构形成、神经元发育等与神经系统功能密切相关的过程,这与GBM起源于神经胶质细胞的特性相吻合,也暗示了LLPS可能通过影响神经元功能相关通路来促进肿瘤的发生发展。
GBM分子亚型:免疫活跃与神经分化
基于DELRGs的表达谱,研究团队将GBM患者样本划分为两个截然不同的分子亚型:
- 免疫活跃型(cluster A): 该亚型表现出更强的免疫细胞浸润和免疫相关通路的激活,提示其肿瘤微环境可能更倾向于免疫炎症反应。
- 神经分化型(cluster B): 该亚型则表现出与神经元分化和发育相关的基因表达特征,可能代表了肿瘤细胞具有更强的神经元样分化潜能。
这种分子亚型划分不仅有助于我们更深入地理解GBM的异质性,也为未来根据患者亚型制定个性化治疗方案提供了理论依据。
LLPS活性在壁细胞中的特异性升高
通过单细胞RNA测序数据分析,研究进一步揭示了LLPS活性在GBM肿瘤微环境中的壁细胞(mural cells)中特异性升高。壁细胞是血管周围的细胞,包括周细胞和血管平滑肌细胞,它们在肿瘤血管生成和维持肿瘤微环境稳定中发挥重要作用。这一发现提示LLPS可能通过影响壁细胞功能,间接调控GBM的血管生成和免疫抑制,为针对肿瘤微环境的治疗提供了新的靶点。
9基因预后模型:精准预测GBM患者生存期
该研究最引人注目的成果之一是成功构建并验证了一个基于9个关键DELRGs的预后风险评分模型。这9个关键基因包括FKBP1B、FLNC等,它们被筛选出来作为预测GBM患者生存期的核心生物标志物。
模型的构建与验证
研究团队在TCGA队列中构建了该风险评分模型,并将其应用于多个独立的外部队列(REMBRANDT、CGGA325、CGGA693)进行严格验证。结果显示:
- 显著的生存期差异: 在所有验证队列中,低风险组患者的中位生存期均显著优于高风险组患者。这表明该模型能够有效区分预后良好和预后不良的GBM患者。
- 独立的预后因素: 进一步分析证实,该风险评分是一个独立的预后因素,其预测能力不受其他临床病理特征(如年龄、肿瘤分级等)的影响。
- 高临床实用性: 基于该风险评分构建的列线图(Nomogram)能够直观地预测GBM患者的1年、3年和5年生存率。在TCGA队列中,预测1年、3年和5年生存率的曲线下面积(AUC)分别达到0.795、0.894和0.913,显示出极高的预测准确性。决策曲线分析也进一步证实了该模型在临床实践中的实用价值。
这个9基因预后模型为GBM患者的精准预后评估提供了一个强有力的工具,有助于临床医生更好地进行风险分层,并为患者制定更个性化的治疗方案。
高低风险组的生物学差异与治疗启示
除了预后预测能力,该研究还深入揭示了高风险组和低风险组之间显著的生物学差异,这些差异为理解GBM的治疗抵抗机制和开发新的治疗策略提供了重要线索。
高风险组的特征与治疗挑战
高风险组患者表现出以下几个显著特征:
- 免疫检查点表达升高: 高风险组的免疫检查点(如CD44)评分更高。CD44是一种细胞表面糖蛋白,在多种肿瘤中与肿瘤干细胞特性、侵袭转移和免疫逃逸相关。高表达的免疫检查点通常意味着肿瘤微环境具有更强的免疫抑制性,这可能解释了免疫治疗在这些患者中效果不佳的原因。
- 缺氧评分更高: 肿瘤内部的缺氧环境是GBM的一个重要特征,它不仅促进肿瘤细胞的增殖和侵袭,还与化疗和放疗抵抗密切相关。高风险组的缺氧评分更高,提示这些患者可能对缺氧诱导的治疗抵抗更为敏感。
- 突变负荷较低: 肿瘤突变负荷(TMB)是预测免疫检查点抑制剂疗效的重要生物标志物。通常,TMB较高的肿瘤对免疫治疗的反应更好。高风险组的TMB较低,进一步支持了其对免疫治疗可能不敏感的推测。
- 对化疗药物更耐药: 重要的是,高风险组患者对常用化疗药物如顺铂(Cisplatin)和索拉非尼(Sorafenib)表现出更强的耐药性。顺铂是一种铂类化疗药物,通过形成DNA加合物抑制DNA复制和转录,诱导细胞凋亡。索拉非尼是一种多靶点酪氨酸激酶抑制剂,主要抑制RAF、VEGFR和PDGFR等激酶,从而抑制肿瘤细胞增殖和血管生成。高风险组对这些药物的耐药性提示,针对这些患者可能需要探索新的化疗方案、联合治疗策略或靶向LLPS相关基因的药物。
对于胶质母细胞瘤患者而言,了解最新的研究进展和治疗选择至关重要。MedFind平台提供 药物信息、治疗方案解读、临床研究与指南资讯,帮助患者和家属获取权威、专业的医学知识。
低风险组的特征与潜在治疗机会
相比之下,低风险组患者则呈现出不同的生物学特征:
- IDO1表达更高: 吲哚胺2,3-双加氧酶1(IDO1)是一种关键的免疫检查点酶,通过降解色氨酸产生犬尿氨酸,从而抑制T细胞功能,促进免疫耐受。低风险组中IDO1表达更高,这可能提示针对IDO1的抑制剂可能对这部分患者有效,尽管IDO1抑制剂在临床试验中效果尚不明确。
- DNA修复通路更活跃: DNA修复通路的活跃性与细胞对DNA损伤剂(如化疗药物和放疗)的抵抗能力密切相关。低风险组DNA修复通路更活跃,可能意味着这些患者对某些DNA损伤剂的反应性较好,或者需要结合DNA修复抑制剂来增强治疗效果。
此外,单细胞数据验证了9个关键基因在GBM中的表达,其中HSPB1、PLK2、MTHFD2的表达尤为突出。研究还构建了一个包含59个转录因子与192个miRNA的复杂调控网络,揭示了LLPS相关基因表达的精细调控机制,为进一步的功能研究和靶点开发提供了丰富的资源。
面对复杂的治疗决策,患者和家属可能需要专业的指导。MedFind的 AI辅助问诊服务 可以提供个性化的初步咨询,解答疑问,辅助您更好地理解病情和治疗选项。
临床转化意义与未来展望
Chun Zeng/Fusheng Liu教授团队的这项研究具有重要的临床转化意义,为胶质母细胞瘤的诊疗带来了新的希望。
精准预后与个性化治疗
该研究系统阐明了LLPS相关基因在GBM免疫微环境调控、预后评估及化疗抵抗中的关键作用,并成功构建了一个9基因预后模型。这个模型不仅为GBM的预后分层提供了新工具,使医生能够更精准地评估患者的预后风险,从而指导临床决策,例如选择更积极的治疗方案或进行更密切的随访。更重要的是,通过识别高风险组患者对顺铂和索拉非尼等药物的耐药性,该研究为克服肿瘤免疫抑制及药物抵抗提供了潜在的干预靶点。未来,可以根据患者的LLPS相关基因表达谱,为患者量身定制个性化的治疗策略,避免无效治疗,提高治疗效率。
潜在的治疗靶点开发
研究中识别出的核心DELRGs,如TP53、CDK1、FKBP1B、FLNC以及在单细胞层面表达突出的HSPB1、PLK2、MTHFD2等,都可能成为未来药物开发的潜在靶点。针对这些基因或其调控的LLPS过程进行干预,有望开发出新型的靶向药物,以克服GBM的治疗抵抗,特别是针对免疫抑制和化疗耐药的难题。
未来研究方向
尽管这项研究取得了显著进展,但仍有许多工作需要进一步深入:
- 更大规模的临床验证: 该9基因预后模型需要在更大规模、多中心的前瞻性临床队列中进行进一步验证,以确认其在不同人群和地域的普适性。
- 功能机制的深入探索: 对关键DELRGs的功能机制进行更深入的分子生物学和细胞生物学研究,例如通过基因敲除/敲入、蛋白质互作等实验,阐明它们如何具体调控LLPS过程以及LLPS如何影响GBM的生物学行为。
- 联合治疗策略的探索: 基于高低风险组的生物学差异,可以设计新的联合治疗方案。例如,对于高风险组患者,可以尝试结合LLPS抑制剂、免疫检查点抑制剂或针对缺氧微环境的药物;对于低风险组,可以探索IDO1抑制剂或DNA修复通路调控剂的潜力。
- 药物筛选与开发: 利用高通量筛选技术,寻找能够调节LLPS过程或直接靶向关键DELRGs的小分子化合物,为GBM的新药研发提供候选分子。
这项研究为我们理解胶质母细胞瘤的复杂性提供了新的视角,并为未来的精准医疗和新药开发奠定了坚实的基础。随着对LLPS机制的深入理解和相关靶向药物的开发,我们有理由相信,胶质母细胞瘤患者的预后将得到显著改善。
对于文中提及的或正在研发中的创新药物,若在国内尚未上市或难以获取,MedFind提供 抗癌药品代购与国际直邮服务,确保患者能够及时获得所需的海外前沿药物。