PD-L1阴性头颈癌治疗迎来新曙光
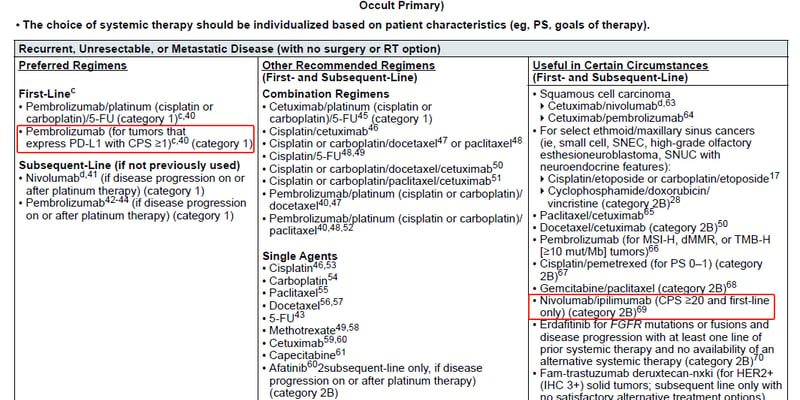
对于PD-L1表达水平较低(CPS
药物开发商Immutep公司宣布,FDA认可了Eftilagimod alfa联合帕博利珠单抗(Pembrolizumab,商品名:Keytruda)在一线治疗PD-L1阴性HNSCC患者中的巨大潜力。这一积极评价主要基于IIb期TACTI-003/KEYNOTE-C34临床试验的鼓舞人心的结果。
FDA的反馈为该联合疗法的加速批准铺平了道路,可能通过以下两种途径实现:
- 开展一项随机注册性试验,将“Eftilagimod alfa + 帕博利珠单抗”方案与标准治疗进行头对头比较。
- 通过一项规模较小的单臂研究,以总缓解率(ORR)、缓解持续时间(DOR)和安全性为终点,寻求加速批准,并后续进行随机对照试验证实其疗效。
Immutep公司首席执行官Marc Voigt表示:“我们对FDA的反馈和指导感到非常高兴,这凸显了PD-L1表达水平低于1的头颈癌患者存在着巨大的未满足医疗需求。FDA的反馈为我们探索未来的合作开发路径提供了支持,致力于为这一服务不足的患者群体带来一种全新、有效且安全的治疗选择。” 如果您对头颈癌的治疗方案或新药有任何疑问,可以咨询MedFind的AI问诊服务,获取专业的解答和支持。
TACTI-003研究:疗效数据令人鼓舞
在2024年ESMO免疫肿瘤学(IO)大会上公布的TACTI-003试验B组数据显示,该联合疗法在PD-L1阴性患者中展现出卓越的抗肿瘤活性。在31名可评估疗效的患者中:
- 客观缓解率(ORR):根据RECIST 1.1标准,ORR达到35.5%,其中包括12.9%的完全缓解(CR)和22.6%的部分缓解(PR)。
- 疾病控制率(DCR):DCR为58.1%,意味着超过一半的患者病情得到控制。
- 总生存期(OS):更新的数据显示,患者的中位总生存期达到了17.6个月,这是一个非常积极的信号。
- 无进展生存期(PFS):中位PFS为5.8个月。
安全性与耐受性分析
安全性方面,Eftilagimod alfa联合帕博利珠单抗的方案表现出良好的耐受性。数据显示,3级或以上的不良事件(AEs)发生率仅为15.2%,且未报告严重不良事件或导致死亡的事件。因不良事件导致治疗中断的患者比例为9.1%。
最常见的任何级别不良事件(发生率≥15%)包括疲劳、恶心、体重下降、甲状腺功能减退、便秘、发热、关节痛、腹泻和贫血等,这些副作用在临床上通常是可控的。
关于TACTI-003试验
TACTI-003是一项国际性的、开放标签的研究,旨在评估Eftilagimod alfa联合帕博利珠单抗作为一线疗法治疗复发或转移性HNSCC患者的疗效和安全性。研究根据患者的PD-L1表达水平将其分为不同队列,其中B组专门纳入了CPS评分低于1的患者。该研究的积极结果,为PD-L1阴性头颈癌患者提供了一种极具前景的治疗新策略。