编者按:免疫治疗作为癌症治疗领域的重大突破,正以前所未有的速度改变着肺癌的治疗格局。从早期可手术的患者到晚期转移性病灶,免疫疗法正在不断拓展其应用边界,并与其他治疗手段如化疗、靶向治疗等相结合,展现出令人振奋的应用前景。
为了帮助患者和临床医生更好地理解肺癌免疫治疗的最新进展,我们特别邀请到中国医学科学院肿瘤医院的仲佳教授,就非小细胞肺癌(NSCLC)免疫治疗的现状、挑战与未来方向进行了深入探讨。
早期肺癌:新辅助免疫治疗的崛起
近年来,免疫治疗在早期非小细胞肺癌的新辅助治疗(手术前治疗)中取得了显著进展。仲佳教授指出,多项重要的临床研究,如CheckMate-816,已经证实了新辅助免疫治疗的有效性,并获得了相应的适应症批准。此外,一些创新的“三明治”式治疗模式(术前免疫联合化疗,术后辅助免疫)也在临床研究中显示出积极成果,例如KEYNOTE-671、NEOTORCH和RATIONALE-315等研究。
这些研究一致表明,对于驱动基因阴性的NSCLC患者,新型免疫治疗在围手术期(手术前后)的应用至关重要。它能显著提高患者的主要病理缓解(MPR)和病理完全缓解(PCR)率。特别是KEYNOTE-671研究,还观察到了长期的无病生存期(DFS)和总生存期(OS)获益。仲佳教授强调,未来在驱动基因阴性NSCLC的新辅助治疗领域,免疫治疗将占据核心地位,成为改善患者预后和生存的关键手段。
晚期NSCLC:优化免疫治疗策略以提升生存率
在晚期非小细胞肺癌的治疗中,免疫治疗的应用已非常广泛。对于PD-L1高表达的患者,帕博利珠单抗(俗称“K药”)或阿替利珠单抗等PD-1抑制剂单药治疗已是标准选择。而对于PD-L1中低表达或阴性的患者,则通常采用免疫联合化疗的模式。
仲佳教授引用了多项关键临床研究数据,如KEYNOTE-407和KEYNOTE-189(评估帕博利珠单抗联合化疗),以及RATIONALE-304和RATIONALE-307(评估替雷利珠单抗联合化疗)。这些研究的长期随访结果显示,在未经PD-L1选择的晚期NSCLC人群中,一线免疫联合化疗的五年OS率已接近20%,部分研究的四年OS率甚至超过30%。这证明免疫治疗已帮助部分晚期患者实现了长期生存。
然而,仍有挑战需要克服。如何进一步优化PD-L1阴性患者的治疗策略?哪些患者适合采用降阶梯治疗(如单药免疫)?何时是免疫治疗的最佳停药时机?这些问题都需要深入研究。同时,结合动态生物标志物检测来指导治疗决策,也是未来的重要方向。
双免疫治疗:协同增效,尤其惠及PD-L1阴性患者
双免疫治疗,特别是PD-1抑制剂联合CTLA-4抑制剂,在晚期NSCLC中显示出长期生存优势。仲佳教授解释了其协同机制:CTLA-4抑制剂作用于T细胞早期激活阶段,促进增殖;PD-1抑制剂作用于T细胞效应阶段,解除肿瘤免疫抑制。两者联合能更全面地激活抗肿瘤免疫反应。
临床研究数据支持了这一理论。CheckMate 9LA研究显示,纳武利尤单抗(俗称“O药”)联合伊匹木单抗(俗称“Y药”)在晚期NSCLC一线治疗中带来显著生存获益。CheckMate 227研究进一步表明,无论PD-L1表达高低,O+Y联合治疗的中位OS均优于化疗,尤其在PD-L1<1%的患者中优势更明显。此外,国产双抗药物如卡度尼利单抗和齐鲁制药的艾托组合抗体(PD-1/CTLA-4双特异性抗体)的前期研究也观察到在PD-L1阴性人群中的良好疗效。
仲佳教授总结,无论从机制还是现有数据看,双免疫检查点抑制剂在PD-L1阴性人群中具有明显优势。随着更多Ⅲ期临床研究(如卡度尼利单抗联合化疗对比替雷利珠单抗联合化疗的研究)数据的公布,双抗治疗有望成为未来重要的治疗选择。
免疫治疗与靶向药的联合探索:JAK1抑制剂带来新希望
免疫治疗与靶向治疗的联合一直是研究热点。仲佳教授回顾了早期免疫联合EGFR-TKI的尝试,发现疗效提升不显著,反而增加了不良反应。因此,对于驱动基因阳性患者,目前很少开展免疫联合EGFR-TKI的研究。
然而,随着对免疫相关靶点的深入了解,新的联合策略正在出现。例如,JAK1抑制剂伊塔替尼。2024年《科学》杂志的一项研究显示,伊塔替尼与PD-1抑制剂帕博利珠单抗联合使用,在转移性NSCLC一线治疗中具有协同作用。这种联合通过抑制JAK1信号通路,减少T细胞耗竭,改善免疫微环境。同时,JAK1抑制剂还能帮助管理免疫相关不良反应,提高了治疗的安全性。
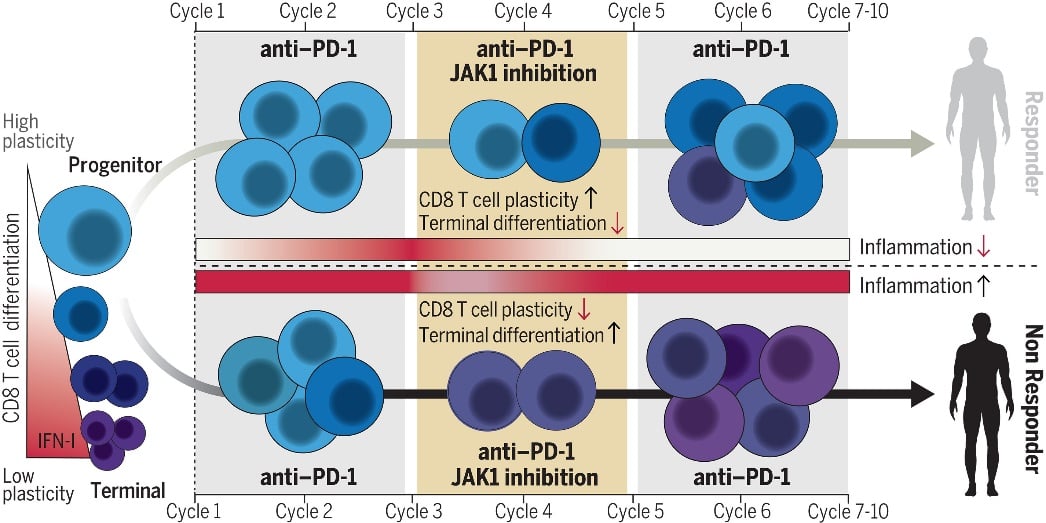
图 JAK抑制剂增强肺癌患者对PD-1单抗的免疫疗效
仲佳教授认为,这种联合治疗方式具有广阔的应用前景。目前正在进行的临床研究将进一步验证其疗效和安全性。对于需要获取这些前沿靶向药或抗癌药的患者,了解其可及性至关重要。MedFind提供海外靶向药代购服务,帮助患者获取所需药物。
生物标志物:超越PD-L1,探索更精准的预测指标
PD-L1表达目前仍是预测免疫治疗疗效最常用且成本较低的生物标志物。然而,仲佳教授坦承,仅依靠PD-L1是不够的。有些PD-L1高表达患者疗效不佳,而部分PD-L1阴性患者却能获益。这是因为免疫治疗涉及肿瘤新生抗原释放、抗原呈递、T细胞识别与攻击、以及免疫微环境等多个复杂环节。
仲佳教授团队正致力于探索复合性生物标志物,整合免疫治疗多个环节的数据,以建立更高效的预测模型。他们创新性地研究了TMB(肿瘤突变负荷)网络突变算法和TCR(T细胞受体)的预测效能。此外,动态监测外周血中的ctDNA(循环肿瘤DNA)变化也被发现与免疫治疗疗效密切相关(如基线ctDNA是否阳性、治疗后是否清除)。这些研究旨在更精准地识别免疫治疗的优势人群。
面对复杂的治疗方案和不断更新的药物信息,患者和家属可能需要专业的指导。MedFind的AI问诊服务可以提供初步的药物信息和治疗方案参考,辅助患者做出决策。同时,MedFind网站还提供丰富的药物信息、诊疗指南等抗癌资讯,帮助患者全面了解疾病和治疗。
总而言之,肺癌免疫治疗正以前所未有的速度发展,从早期到晚期,从单药到联合,不断为患者带来新的希望。对前沿治疗策略的深入理解和对新型生物标志物的探索,将共同推动肺癌治疗迈向更精准、更有效的未来。