透明细胞肾细胞癌(ccRCC)是肾细胞癌中最常见的亚型,但我们对其潜在风险基因的了解仍然有限。这一知识空白给ccRCC的有效诊断和治疗带来了挑战。
近期,一项发表在《Nature Communications》上的重要研究带来了新突破。来自西北工业大学、四川大学华西医院和天津大学的研究团队共同提出了一种基于深度强化学习的计算方法——RL-GenRisk,旨在更精准地识别ccRCC的风险基因。
与传统的基因识别模型不同,RL-GenRisk将风险基因的识别过程模拟为一个马尔可夫决策过程,并巧妙地结合了图卷积网络和深度Q网络。更重要的是,研究人员设计了一种数据驱动的奖励机制,有效克服了已知风险基因稀缺的限制。评估结果显示,RL-GenRisk在ccRCC风险基因鉴定方面表现优于现有方法。
利用RL-GenRisk,研究团队成功鉴定出8个潜在的ccRCC风险基因,并通过独立的实验数据和生物学验证,重点确认了表皮生长因子受体(EGFR)和小胶质细胞突触前基质蛋白(PCLO)这两个基因的重要性。研究发现,在ccRCC患者中,EGFR基因在细胞和单细胞层面均显著上调,其编码的蛋白质过表达与患者较差的生存率密切相关。体外实验表明,降低EGFR表达能促进ccRCC细胞凋亡并抑制其生长和迁移。进一步的体内外实验证实,使用EGFR抑制剂厄洛替尼可以有效增强细胞凋亡并抑制肿瘤生长。

肾细胞癌(RCC)是全球常见的癌症之一,其中ccRCC占多数。由于其侵袭性强且易发生转移,ccRCC的治疗面临诸多挑战。尽管已有多种药物问世,但由于肿瘤的异质性,疗效仍有局限。因此,深入了解ccRCC的发病机制并识别关键风险基因,对于实现早期诊断和开发更有效的靶向治疗方案至关重要。
癌症是一种复杂的遗传性疾病,其发生发展与基因突变累积密切相关。传统的风险基因识别方法主要依赖于基因突变频率,但这容易忽略那些突变频率低但对肿瘤发生发展至关重要的基因(例如PIK3CA在ccRCC中突变率不高但被证实是风险基因)。为了弥补这一不足,一些方法开始考虑蛋白质相互作用网络,但仍存在无监督方法易受噪声影响、有监督方法依赖大量已知标记数据等问题。
RL-GenRisk方法的提出,正是为了克服这些现有方法的局限性。通过深度强化学习,该模型能够更好地利用环境交互进行优化,尤其适用于已知风险基因数据稀缺的情况。它不仅能准确识别高突变频率基因,还能发现那些在功能上与高突变频率基因相互作用的潜在风险基因。
这项研究不仅为理解ccRCC的发病机制提供了新视角,更重要的是,通过验证EGFR作为潜在靶点,为开发或优化针对EGFR通路的靶向治疗药物提供了坚实依据。对于需要EGFR抑制剂厄洛替尼或其他相关靶向药的患者而言,了解药物信息、获取途径以及仿制药选项至关重要。
在寻求最佳治疗方案的过程中,患者和家属往往需要大量专业信息和支持。了解最新的研究进展、药物信息和诊疗指南是关键一步。MedFind网站提供丰富的抗癌资讯,帮助患者获取权威信息。同时,面对海外新药或仿制药的需求,MedFind提供专业的海外靶向药代购服务,致力于帮助患者获取急需的救命药。此外,MedFind的AI问诊服务也能为患者提供初步的个性化咨询,辅助患者更好地理解病情和治疗方向。
这项基于AI的基因识别研究为肾细胞癌的精准诊疗开辟了新的可能性,未来这种方法也有望应用于其他疾病的研究。
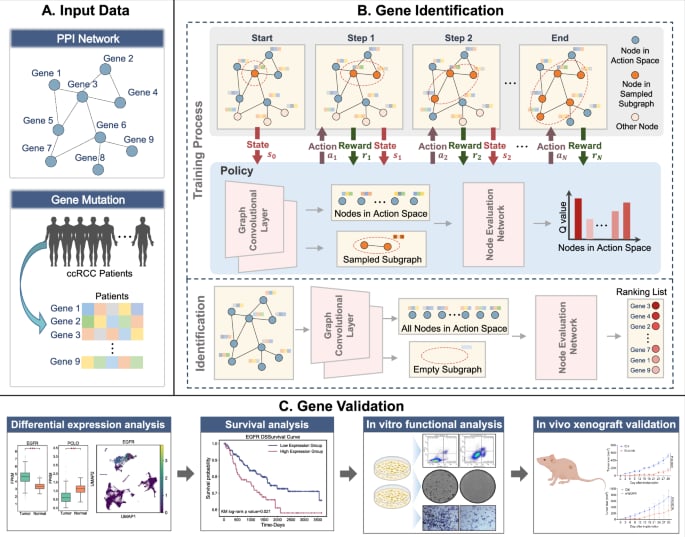
图1 工作流程图(改编自Nature Communications)