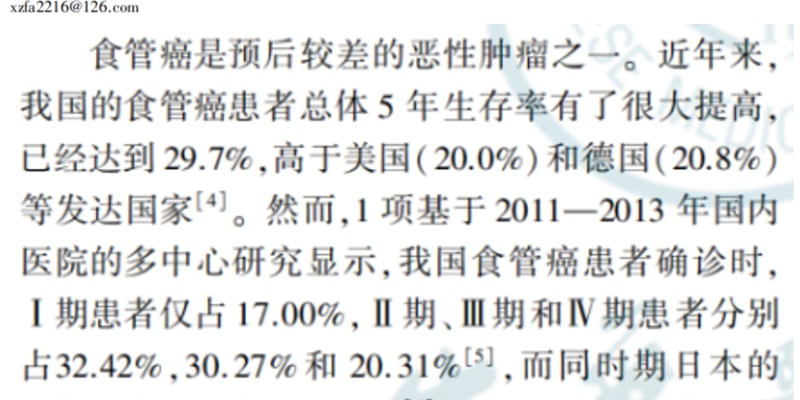
引言
肿瘤的生长、侵袭乃至转移,都离不开一个关键环节——新血管的形成,即肿瘤血管生成。这是一个受多种促血管生成和抗血管生成因子精密调控的复杂过程。随着我们对分子生物学的深入理解,参与其中的关键角色,如血管内皮生长因子(VEGF)、成纤维细胞生长因子(FGF)等逐渐被揭示。基于这些发现,靶向抑制肿瘤血管生成的治疗策略应运而生,成为极具潜力的抗癌手段。
目前,应用最广泛的抗血管生成药物主要包括针对VEGF的单克隆抗体和多靶点酪氨酸激酶抑制剂(TKIs)。然而,这类靶向药在临床应用中仍面临挑战,如副作用、获得性耐药、肿瘤复发以及缺乏有效的预测标志物等,限制了其临床效益。这促使研究人员不断探索肿瘤血管生成的深层机制,开发新型药物和联合疗法,以期提高治疗效果。
一、肿瘤血管生成的病理生理学特点
正常的组织血管结构成熟稳定,内皮细胞连接紧密,周细胞覆盖完整,确保血液有效循环。但在肿瘤组织中,情况截然不同。肿瘤细胞带来的机械压力导致血管形态异常,厚薄不均,结构扭曲,常呈不规则的出芽状,反而阻碍了血液流动。同时,淋巴管也受损,影响间质液回流。肿瘤血管壁脆弱且通透性高,内皮细胞和周细胞排列紊乱,易导致血液渗漏和灌注不畅。这种结构和功能的异常造成了肿瘤微环境的低氧、酸性及高间质压,这些因素反过来又进一步刺激肿瘤血管生成、侵袭和转移。
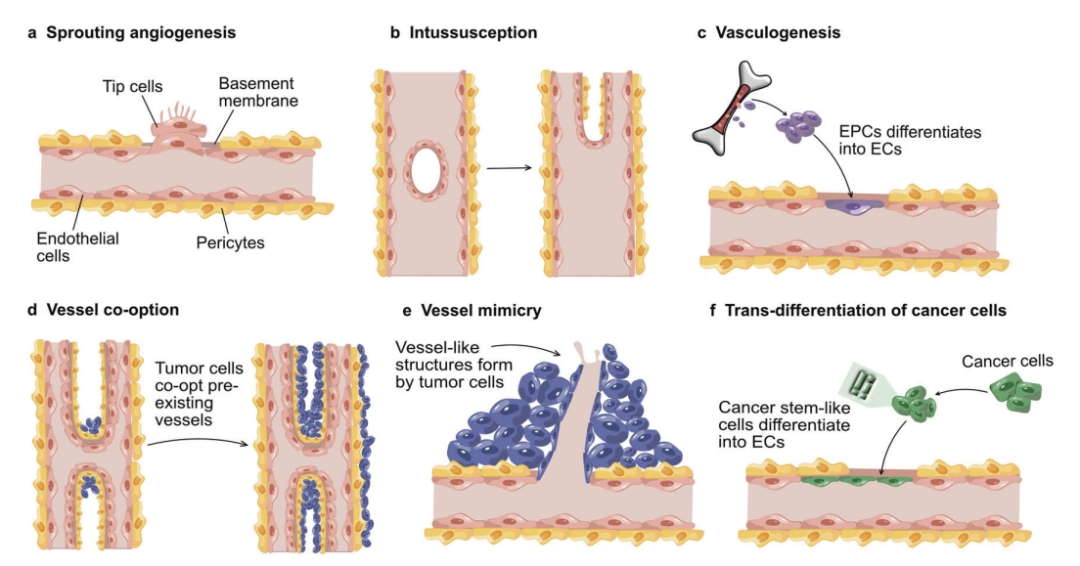
肿瘤血管生成并非只有一种模式,主要包括:
- 血管出芽生成 (Sprouting Angiogenesis):最经典的方式,从现有血管壁上“发芽”,形成新的血管分支,逐渐延伸至肿瘤内部。
- 套叠式血管生成 (Intussusceptive Angiogenesis):血管腔内形成隔断,将一条血管分裂成两条。
- 血管发生 (Vasculogenesis):骨髓来源或血管壁固有的内皮祖细胞分化为内皮细胞,从头形成新血管。
- 血管选择 (Vessel Co-option):肿瘤细胞沿着已存在的血管迁移、浸润并包裹它们,利用现有血管获取养分。
- 血管模拟 (Vasculogenic Mimicry):肿瘤细胞自身形成管状结构,模拟血管腔,并与现有血管连接。
- 癌症干细胞分化:特定的癌症干细胞能转分化为内皮样细胞,参与血管形成。
二、驱动肿瘤血管生成的关键分子与信号通路
肿瘤血管生成是一个由多种生物分子构成的复杂调控网络,这些分子或促进或抑制血管形成。关键参与者包括:
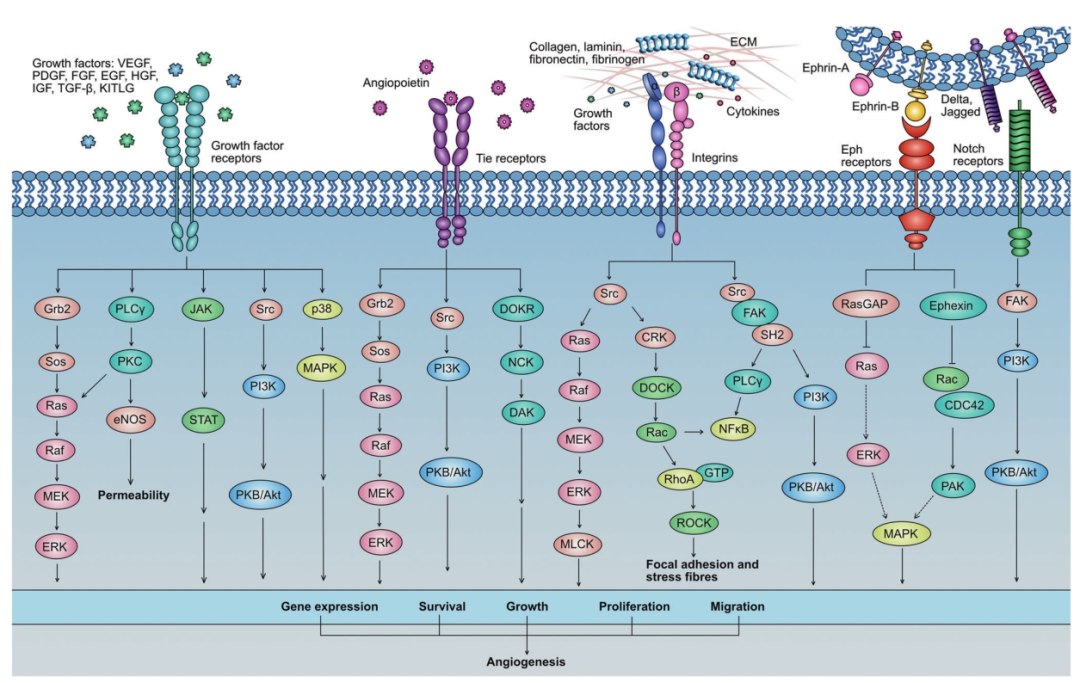
- VEGF/VEGFR通路: VEGF-A是核心调控因子,通过其受体VEGFR-2激活信号,强烈刺激内皮细胞增殖、迁移和血管形成,是抗血管生成靶向药的主要目标。
- PDGF/PDGFR通路: 血小板衍生生长因子(PDGF)主要作用于周细胞和平滑肌细胞,参与血管成熟和稳定。PDGF信号异常可促进血管生成和对抗VEGF治疗的耐药。
- EGF/EGFR通路: 表皮生长因子(EGF)通过EGFR不仅促进肿瘤细胞生长,也能间接上调VEGF等因子,促进血管生成。
- FGF/FGFR通路: 成纤维细胞生长因子(FGF),特别是FGF-2 (bFGF),是有效的内皮细胞促分裂原,在多种癌症中过表达,与转移和不良预后相关。
- HGF/c-Met通路: 肝细胞生长因子(HGF)及其受体c-Met信号异常,可促进肿瘤扩散、侵袭和血管生成。
- IGF/IGFR通路: 胰岛素样生长因子(IGF)可诱导VEGF合成,促进血管生成。
- TGF-β通路: 转化生长因子-β(TGF-β)作用复杂,既可抑制也可促进血管生成,在肿瘤进展中常诱导内皮细胞迁移和VEGF等表达。
- HIF-1通路: 缺氧诱导因子-1(HIF-1)是细胞应对低氧的关键转录因子,能上调多种促血管生成因子(如VEGF、PDGF等)的表达。
- 整合素 (Integrins): 作为细胞粘附分子,特定整合素(如αvβ3, αvβ5)在血管内皮细胞粘附、迁移中扮演重要角色,参与介导不同生长因子诱导的血管生成。
- 蛋白水解酶 (MMPs): 基质金属蛋白酶(如MMP-2, MMP-9)降解细胞外基质,为内皮细胞迁移和血管重塑创造条件。
- NF-κB通路: 核因子κB(NF-κB)作为转录因子,间接调控多种血管生成因子的表达。
- 血管生成素 (Angiopoietins): Ang-1和Ang-2与其受体Tie2相互作用,调控血管的成熟与稳定,在肿瘤中常失衡。
- Notch通路: 调控细胞分化和命运决定,在血管生成中参与“尖端细胞”和“柄细胞”的选择,影响血管分支模式。
- Ephrin/EphR通路: EphrinB2/EphB4信号对血管出芽、成熟和动静脉分化至关重要。
三、抗肿瘤血管生成药物的研究进展
抗血管生成治疗旨在通过抑制肿瘤的血液供应来控制其生长和转移。尽管涉及的分子通路众多,目前研发的抗血管生成药物仍主要聚焦于VEGF/VEGFR通路。主要药物类型包括:
- 单克隆抗体:贝伐珠单抗 (Bevacizumab, 安维汀/Avastin): 第一个获批的抗VEGF抗体,通过中和VEGF-A发挥作用。已广泛用于结直肠癌、肺癌、肾癌等多种实体瘤的治疗。
- 雷莫芦单抗 (Ramucirumab, Cyramza): 靶向VEGFR-2的抗体,批准用于治疗晚期胃癌、结直肠癌、肺癌等。
- Olaratumab (Lartruvo): 靶向PDGFRα的抗体,曾被批准用于软组织肉瘤(后因III期试验失败撤市)。
- 寡核苷酸衍生物:哌加他尼 (Pegaptanib, Macugen): 靶向VEGF-A的RNA适配体,主要用于眼科疾病(如湿性AMD)。
- 重组融合蛋白:阿柏西普 (Aflibercept, Eylea/Zaltrap): 作为VEGF“诱饵受体”,结合VEGF-A、VEGF-B和PlGF。用于眼科疾病和转移性结直肠癌。
- mTOR抑制剂:依维莫司 (Everolimus, RAD001/Afinitor): 口服mTOR抑制剂,间接抑制HIF-1α和VEGF的产生。批准用于肾细胞癌、乳腺癌、神经内分泌瘤等。
- 西罗莫司 (Temsirolimus, Torisel): 另一种mTOR抑制剂,批准用于晚期肾细胞癌和套细胞淋巴瘤。
- 小分子酪氨酸激酶抑制剂 (TKIs): 这类药物通常是多靶点抑制剂,除了VEGFR外,常同时抑制PDGFR、FGFR、c-Kit、RET等多个与血管生成和肿瘤生长相关的激酶。
- 索拉非尼 (Sorafenib, 多吉美/Nexavar): 首个获批用于晚期肾细胞癌的小分子TKI,也用于肝癌和甲状腺癌。
- 舒尼替尼 (Sunitinib, 索坦/Sutent): 批准用于肾细胞癌、胃肠道间质瘤和胰腺神经内分泌瘤。
- 帕唑帕尼 (Pazopanib, Votrient): 用于晚期肾细胞癌和软组织肉瘤。
- 其他: 还包括仑伐替尼 (Lenvatinib)、阿昔替尼 (Axitinib)、卡博替尼 (Cabozantinib)、瑞戈非尼 (Regorafenib)、凡德他尼 (Vandetanib)等,各自有不同的靶点谱和适应症。
对于需要这些靶向药或其仿制药的患者,了解其海外购药渠道和价格信息至关重要。MedFind提供专业的靶向药代购服务,致力于帮助患者获取所需治疗方案。
四、抗血管生成治疗的挑战与局限
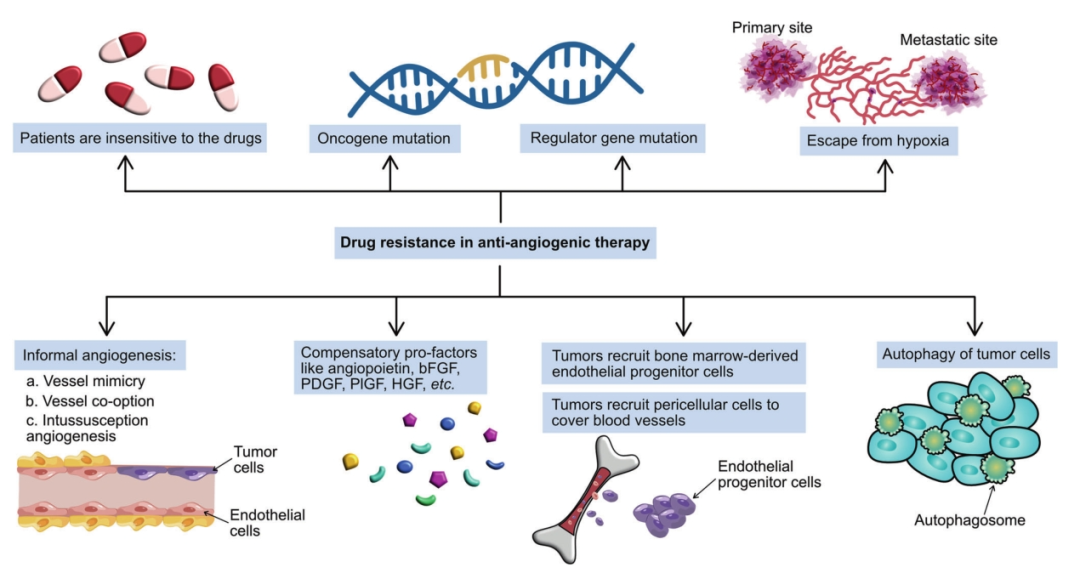
尽管抗血管生成药物为癌症治疗带来了新希望,但其应用仍面临一些严峻挑战:
- 安全性和有效性问题: 与最初的预期不同,抗血管生成治疗并非没有毒性。常见的副作用包括高血压、蛋白尿、出血、血栓、疲劳、手足综合征等,严重时可能影响治疗的持续性。此外,虽然短期内能抑制肿瘤生长,但长期可能诱导肿瘤更具侵袭性,停药后也可能出现肿瘤快速复发。
- 耐药性: 这是限制靶向治疗疗效的主要障碍。耐药机制复杂多样,包括:
- 激活其他替代的促血管生成信号通路(如FGF、EGF等)。
- 募集骨髓来源的细胞(如内皮祖细胞、巨噬细胞)来支持血管形成。
- 周细胞覆盖增加,保护血管免受药物攻击。
- 肿瘤细胞通过血管模拟等非经典方式获取血液供应。
- 肿瘤微环境的异质性、基因突变、肿瘤干细胞等因素也参与其中。
- 缺乏有效的生物标志物: 目前仍缺乏可靠的生物标志物来预测哪些患者能从抗血管生成治疗中获益最大,或预测副作用风险。这使得个体化治疗选择变得困难。开发有效的生物标志物是该领域面临的重大挑战。
结语
肿瘤血管生成是癌症发展的关键支撑,靶向这一过程的抗血管生成治疗已成为重要的抗癌策略之一。然而,疗效有限、副作用和耐药等问题提示我们仍需深入探索。未来的研究方向包括开发针对新靶点的药物、寻找克服耐药的联合治疗方案,以及发现可靠的生物标志物用于指导临床决策。
随着对肿瘤血管生成、肿瘤微环境及耐药机制理解的不断加深,我们有理由相信,抗血管生成治疗将不断优化,为癌症患者带来更多福祉。获取最新的抗癌药资讯、诊疗指南或寻求个性化用药建议,欢迎访问MedFind抗癌资讯栏目或尝试我们的AI问诊服务。
参考资料:
1.Angiogenic signaling pathways and anti-angiogenic therapy for cancer. Signal Transduct Target Ther.2023 May 11;8(1):198