前沿探索:个性化癌症疫苗的潜力
在与癌症的斗争中,科学家们不断探索新的武器。其中,**个性化新抗原肿瘤疫苗**代表了**免疫治疗**领域的一个令人兴奋的方向。癌细胞在发展过程中会产生基因突变,这些突变可能产生身体免疫系统从未见过的新蛋白质片段,即“新抗原”。理论上,基于这些**新抗原**的疫苗具有显著优势:
- 精准靶向:由于新抗原是肿瘤细胞独有的标记,基于它们的疫苗能够引导免疫系统(特别是**T细胞**)精准攻击癌细胞,而不会误伤正常组织,减少“脱靶”副作用。
- 绕过免疫耐受:新抗原是后天产生的,免疫系统通常不会对其产生耐受,因此更容易激发有效的抗肿瘤免疫反应。
- 持久记忆:成功的疫苗能诱导持久的免疫记忆**T细胞**,有望在治疗后长期监控并清除复发的癌细胞。
目前,全球已有超过百项针对新抗原疫苗的**临床试验**正在进行或已经完成。尽管大部分早期试验效果有限,但近期在**黑色素瘤**(NCT03897881)和**胰腺癌**(NCT04161755)的研究中观察到了延长患者无复发生存期的积极信号。然而,要让新抗原疫苗真正成为**癌症治疗**的常规武器,仍需克服一系列严峻的挑战。
挑战重重:新抗原疫苗研发的瓶颈
一、 提升疫苗的“战斗力”:免疫原性难题
尽管新抗原疫苗的种类多样(包括肽、DNA、RNA、病毒载体、树突状细胞等形式),一个普遍存在的问题是它们的**免疫原性**(激发免疫反应的能力)相对较低。许多试验中,疫苗诱导产生的、能够杀伤肿瘤的特异性**T细胞**(尤其是CD8+ CTL)数量非常少,甚至在外周血中难以直接检测到,远不如针对病毒的疫苗效果显著。
这可能源于新抗原自身的特性(与自身蛋白相似度高)、疫苗提供的抗原量不足以及免疫刺激信号不够强。此外,还需要精确调控免疫反应的类型。理想的抗癌反应需要TH1型**T细胞**和CTL细胞的协同作用,而要避免可能促进肿瘤生长的TH2型免疫反应。如何通过优化疫苗配方和佐剂,确保诱导出正确且足够强度的抗癌免疫,是亟待解决的关键。
二、 精准“导航”:新抗原的选择困境
疫苗的效果很大程度上取决于其选用的抗原。虽然二代测序(NGS)技术能帮助我们找到肿瘤细胞的所有突变,但如何从中筛选出真正能被免疫系统识别并有效攻击的**新抗原**,仍然是一个巨大的挑战。目前的生物信息学预测算法准确率有限,预测出的新抗原肽只有极小部分能被患者的**T细胞**识别。
此外,肿瘤内部存在高度异质性,不同区域、甚至不同细胞的突变都可能不同。这意味着基于单个样本预测的新抗原可能只存在于部分癌细胞中。同时,肿瘤细胞还会通过“免疫编辑”过程,丢失掉那些容易被免疫系统攻击的抗原,从而逃避免疫监视。因此,如何准确预测并选择那些存在于所有癌细胞(主干突变)、不易丢失且具有强**免疫原性**的**新抗原**,是开发高效疫苗的核心瓶颈。
三、 优化“配方”:疫苗的设计考量
设计新抗原疫苗时,需要考虑选用哪些新抗原表位?需要包含多少个表位才能达到最佳效果?这些问题尚无定论。如果能找到针对关键驱动突变、能引发强力**T细胞**反应(高TCR亲和力)的**新抗原**,或许少量几个就足够。但大多数新抗原引发的反应较弱,可能需要组合大量的低亲和力新抗原才能达到理想效果。
新抗原肽的长度也是一个重要因素。过短的肽可能直接被非专业的抗原呈递细胞(如普通体细胞)呈递,反而诱导免疫耐受。使用较长的肽段(如SLP、RNA或DNA形式),依赖专业的抗原呈递细胞(如树突状细胞)进行处理和呈递,可能更有利于激发有效的**免疫治疗**反应。
四、 添加“助燃剂”:佐剂的选择与优化
由于**新抗原**本身的**免疫原性**通常不强,尤其对于基于肽的疫苗,必须添加佐剂来增强免疫刺激。佐剂能够激活先天免疫系统,为**T细胞**反应的启动提供必要信号。然而,目前获批用于人体的佐剂种类有限,且大多是为诱导抗体反应设计的,不一定最适合激发抗癌所需的**T细胞**免疫。
开发新型佐剂,特别是那些能强效激活**T细胞**(尤其是TH1和CTL)反应,同时避免诱导不利的TH2反应和过度毒性的佐剂,是提高新抗原疫苗效力的另一个关键环节。例如,TLR激动剂(如CpG)和STING激动剂等正在被积极研究作为潜在的癌症疫苗佐剂。
疫苗接种后的挑战:免疫细胞的“战场”环境
即使成功研发出能诱导强力**新抗原**特异性**T细胞**的疫苗,这些“免疫战士”在真正进入“战场”——肿瘤组织后,仍然面临诸多障碍。
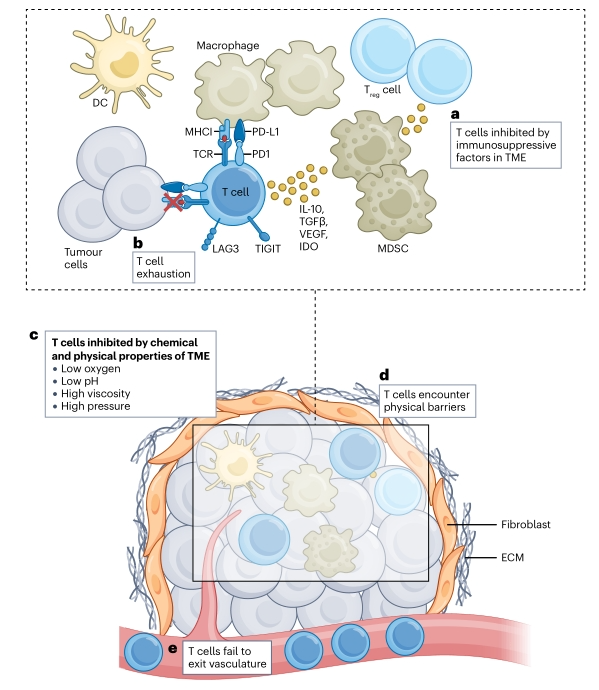
- 肿瘤的“隐身术”:许多肿瘤会降低或丢失**MHC**分子的表达,这是**T细胞**识别癌细胞所必需的“身份证”。没有**MHC**呈递**新抗原**,**T细胞**就如同“盲人摸象”,无法有效识别和攻击目标。
- **肿瘤微环境**(TME)的“陷阱”:肿瘤组织内部充满了各种抑制免疫反应的细胞(如调节性T细胞、髓源抑制细胞)和分子(如TGF-β、IL-10、IDO)。这些因素共同构成了一个免疫抑制性的**肿瘤微环境**,会削弱甚至耗竭进入肿瘤的**T细胞**的功能。
- 物理屏障与“交通堵塞”:一些肿瘤(如**胰腺癌**)会形成致密的纤维化基质,阻碍**T细胞**的浸润。不良的血管结构也可能限制免疫细胞和药物的输送。
- **T细胞**“筋疲力尽”:在持续的抗原刺激和免疫抑制环境下,**T细胞**可能会进入“耗竭”状态,失去杀伤功能。联合免疫检查点抑制剂(ICB)等策略可能有助于克服**T细胞**耗竭。
- 晚期和转移性癌症的复杂性:对于体积较大或已发生转移的晚期癌症,肿瘤负荷高、异质性强、不同转移灶微环境各异,这些都给疫苗的疗效带来了更大挑战。联合化疗、放疗或其他**免疫治疗**可能是必要的策略。
结语与展望
个性化**新抗原肿瘤疫苗**代表了**癌症免疫治疗**的精准化方向,潜力巨大。近年来,在**新抗原**鉴定和疫苗诱导**T细胞**反应方面已取得显著进展。然而,从激发免疫反应到实现有效的临床抗癌效果,仍有漫长的道路要走,需要克服**免疫原性**、抗原选择、佐剂优化、**肿瘤微环境**抑制等多重挑战。
未来的研究需要更深入地理解肿瘤免疫相互作用的复杂机制,开发更智能的预测工具、更有效的疫苗平台和佐剂,并探索与其他疗法(如**靶向药**、免疫检查点抑制剂)的优化组合策略。持续关注**癌症免疫治疗**的最新进展,理解其潜力和局限,对于患者和研究者都至关重要。
参考资料:
1.Heterogeneity of the tumor immunemicroenvironment and its clinical relevance. Exp Hematol Oncol. 2022; 11:24.





