中华医学会肿瘤学分会, 中华医学会杂志社. 中华医学会肺癌临床诊疗指南(2023版)[J]. 中华肿瘤杂志, 2023, 45(7):539-574.
DOI: 10.3760/cma.j.cn112152-20230510-00200.
摘 要
为进一步规范中国肺癌的防治措施、提高肺癌的诊疗水平、改善患者的预后、为各级临床医务人员提供专业的循证医学建议,中华医学会肿瘤学分会组织呼吸内科、肿瘤内科、胸外科、放疗科、影像科和病理科专家,经过共识会议制定了《中华医学会肺癌临床诊疗指南(2023版)》。2023版更新内容包括在筛查部分删除了根据高加索人群流调所确定的肺癌高危人群特征(长期重度吸烟),保留基于中国人群流调确认的肺癌高危人群特征,并建议筛查机构通过完整的说明及介绍使筛查人群充分了解肺癌筛查的益处和局限性。病理部分在组织标本诊断原则中增加了4种神经内分泌肿瘤(典型类癌、不典型类癌、大细胞神经内分泌癌、小细胞肺癌)的病理特点。在外科部分,根据相关临床研究的结果(CALGB140503、JCOG0802、JCOG1211),提出了对于部分外周型病灶可有更多的术式选择。在内科部分,更新内容包括免疫新辅助使得早中期非小细胞肺癌患者的预后大幅改善。在中晚期非小细胞肺癌的治疗中,放化疗后的免疫巩固有了更多的选择,晚期非小细胞肺癌常见的敏感突变基因如表皮生长因子受体突变、间变性淋巴瘤激酶融合和少见靶点如MET外显子14跳跃突变、RET融合、ROS1融合、NTRK融合等都有相应的药物相继获批,使得医师和患者有了更多的选择。此外,多个免疫检查点抑制剂在晚期非小细胞肺癌和小细胞肺癌的治疗中相继获批并写入指南,使得晚期肺癌患者的生存进一步得到了提高。指南以国家批准的应用指征为原则,以国内实际可应用的药品为基础,结合国际指南推荐意见和中国临床实践现状,整合近年来肺癌筛查、诊断、病理、基因检测、免疫分子标志物检测和治疗手段以及随访等诊治方面的最新循证医学证据,旨在为各级临床医师、影像、检验、康复等专业人员提供合理的推荐建议。
【关键词】肺肿瘤;诊断;治疗;指南
原发性支气管肺癌简称肺癌,是我国及世界各国发病率和死亡率较高的恶性肿瘤之一。2022年中国的所有恶性肿瘤新发病例中肺癌排名第1位,占18.06%,而肺癌死亡人数占中国恶性肿瘤死亡总数的23.9%,同样排名第1位。早期肺癌多无明显症状,临床上多数患者出现症状就诊时已属晚期,晚期肺癌患者整体5年生存率在20%左右。
为进一步规范我国肺癌防治措施、提高肺癌诊疗水平、改善患者预后、为各级医师提供专业的循证医学建议,中华医学会肿瘤学分会组织呼吸内科、肿瘤内科、胸外科、放疗科、影像科和病理科专家,结合国际指南和中国国情,整合近年来肺癌诊治新进展,制定了《中华医学会肺癌临床诊疗指南(2023版)》,旨在为各级临床医师提供肺癌筛查、诊断、病理、治疗和随访等方面的循证医学证据和指导性建议。本指南根据循证医学级别进行了分类推荐(表1)。

一肺癌的筛查多年来国内外一直致力于通过筛查来实现肺癌的早诊早治,并最终降低肺癌相关死亡率。2011年美国国家肺癌筛查试验的随机对照研究结果显示,与X线摄影相比,采用低剂量螺旋CT(low-dose computed tomography, LDCT)对肺癌高危人群进行筛查可使肺癌死亡率下降20%。欧美多家权威医学组织的肺癌筛查指南均推荐在高危人群中采用LDCT进行肺癌筛查。近年来,我国越来越多的医疗机构已开展或拟开展LDCT肺癌筛查,但国内对肺癌LDCT筛查的认识和诊疗水平存在较大差异。与西方国家相比,我国的肺癌发病危险因素更为复杂,除吸烟外,在二手烟、环境油烟等综合因素的影响下,我国女性非吸烟人群发生肺癌的比例远高于西方人群,因此,在肺癌筛查的具体实践中必须考虑到东西方差异。基于我国的肺癌筛查实践和既往的国内外筛查指南,本指南制定了如下参考意见。
(一)筛查人群的选择
1.年龄段(2A类推荐证据)
本指南推荐在≥45岁人群中开展肺癌筛查。2015年全国肿瘤统计数据显示,肺癌的年龄别发病率及死亡率在45岁之后显著增加,因此,推荐肺癌筛查的起始年龄为45岁。
2.肺癌的危险因素(2A类推荐证据)
肺癌筛查的获益随着肺癌发病风险的增加而增加,对高危人群进行筛查是目前国内外专家的共识。本指南对于高危人群的选择充分考虑了除年龄外的肺癌危险因素,结合中国肺癌的发病特点,推荐在符合年龄段的基础上,含有下列危险因素之一的人群进行肺癌筛查。
(1)吸烟:吸烟可显著增加肺癌的发病风险。吸烟人群的肺癌发病及死亡风险高于不吸烟人群,既往吸烟人群的肺癌发病和死亡风险亦显著升高,同时,吸烟剂量和肺癌发病风险呈线性正相关趋势。起始吸烟年龄越小、每日吸烟量越大、持续时间越长引发肺癌的相对危险度越大。建议吸烟量≥20包年的人群进行肺癌筛查。吸烟与鳞状细胞癌和小细胞肺癌(small cell lung cancer, SCLC)的关系相对更为密切,鳞状细胞癌和SCLC常呈中央型生长,因此,重度吸烟人群若条件允许可进行荧光支气管镜筛查,同时开展戒烟宣传教育。
(2)二手烟或环境油烟吸入史:亚洲人群中非吸烟女性的肺癌发生率显著高于欧美人群,推测可能与二手烟暴露和厨房等场所的环境油烟暴露有关。Meta分析显示,二手烟暴露显著增加肺癌发生风险。炒炸等烹饪方式产生的厨房油烟可导致DNA损伤或癌变,是中国非吸烟女性罹患肺癌的重要危险因素之一。
(3)职业致癌物质暴露史:长期接触氡、砷、铍、铬、镉及其化合物等高致癌物质者更易罹患肺癌。石棉暴露可显著增加肺癌的发病风险。另外,二氧化硅和煤烟也是明确的肺癌致癌物。
(4)个人肿瘤史:既往罹患其他恶性肿瘤者可能携带异常基因突变,基因突变可增加肺癌的发病风险。对于肺癌基因筛查的研究仍在进行中。
(5)一二级亲属肺癌家族史:一级亲属被诊断为肺癌的个体患肺癌的风险明显升高。有肺癌家族史的人群可能存在可遗传的肺癌易感位点。
(6)慢性肺部疾病史:慢性阻塞性肺疾病、肺结核和肺纤维化等慢性肺部疾病患者肺癌发病率高于健康人群。支气管肺组织的慢性炎症及其在愈合过程中的鳞状上皮化生或增生可能发展成肺癌。
(二)筛查技术
1.LDCT(1类推荐证据)
目前全球发布的肺癌筛查指南均推荐采用LDCT用于肺癌筛查。国内外多项研究均显示,与胸部X线比较,LDCT可显著提高肺癌的检出率并降低肺癌相关死亡率,具有较高的灵敏度和特异度。本指南推荐采用LDCT进行肺癌筛查。
2.其他技术(3类推荐证据)
对于可疑的气道病变,建议采用支气管镜进一步检查。对于重度吸烟的患者,条件允许的情况下,可行荧光支气管镜检查。人工智能辅助技术可降低CT影像读片的压力,并在一定程度上提高肺部结节诊断的准确性。通过外周血循环肿瘤细胞、外泌体、自身抗体、肿瘤游离DNA、microRNA等手段进行肺癌筛查的方法仍在探索中。辅助检测手段和LDCT筛查的联合应用可在一定程度上提高筛查的效果。
(三)筛查频率(2A类推荐证据)
建议肺癌筛查的间隔时间为1年,不推荐间隔时间>2年的筛查模式。年度筛查结果正常的,建议每1~2年继续筛查。
(四)筛查组织人员(1类推荐证据)
实施肺癌筛查的关键是必须有多学科专家共同协作的团队,推荐进行肺癌筛查的医疗机构建立影像科、呼吸内科、胸外科、肿瘤科等在内的多学科协作团队。
(五)筛查CT质控和阅片测量要求(2B类推荐证据)
1.CT质量控制
建议有条件的医疗机构使用16排及以上的多排螺旋CT进行LDCT肺癌筛查。受检者呈仰卧位,吸气末1次屏气完成扫描,扫描范围从肺尖至肋膈角。建议扫描矩阵设定不低于512×512,管电压100~120 kVp,管电流≤40 mAs。扫描后原始数据采用肺算法或标准算法行薄层重建,建议重建层厚为0.625~1.25 mm,层间有20%~30%重叠。肺结节的检测建议将薄层图像进行三维重建,采用最大密度投影重建,有助于结节形态的观察。
2.阅片要求
建议使用DICOM格式在工作站或PACS进行阅片,采用肺窗(窗宽1 500~1 600 HU,窗位-650~-600 HU)及纵隔窗(窗宽350~380 HU,窗位25~40 HU)分别进行阅片。建议采用多平面重组及最大密度投影阅片,多方位显示肺结节的形态学特征。与既往检查进行对比时建议采用图像对比而非报告,这对评估结节具体的大小、形态和密度变化十分重要。
3.测量要求
(1)测量方式:<10 mm的结节长径由整体结节长短轴直径的平均值表示,≥10 mm的结节需要分别测量记录长短径。
(2)测量值的单位:测量结果和均值需记录为最接近的整毫米数(四舍五入法)。
(3)随访对比:判断结节的阶段性生长应使用目前及前次的CT扫描进行对比,但评估结节的长期生长时,推荐与既往的CT扫描进行对比。
(六)筛查结果管理(2A类推荐证据)
1.基线筛查结果管理建议
(1)筛查发现气道病变者建议临床干预,行支气管镜检查,如支气管镜检查结果为阴性,建议进入下年度LDCT筛查;如为阳性,建议多学科会诊后决定是否进行临床治疗或进入下年度高分辨率CT(high resolution computed tomography, HRCT)筛查。
(2)无肺内非钙化性结节检出(阴性结果),或检出的非实性结节平均长径<8 mm,或实性结节/部分实性结节的实性成分平均长径<5 mm,建议进入下年度LDCT筛查。
(3)检出的非实性结节平均长径≥8 mm,或实性结节/部分实性结节的实性成分平均长径≥5 mm,如无法排除恶性结节,建议抗感染治疗或随访后复查HRCT。如结节完全吸收,建议进入下年度LDCT筛查;如结节部分吸收,3个月后复查HRCT;如继续吸收或完全吸收,建议进入下年度LDCT筛查;如无变化或增大,建议多学科会诊后决定是否进行临床治疗。对于高度怀疑恶性的结节,建议进行临床诊疗。
2.年度筛查结果管理建议
(1)筛查发现新发气道病变者建议临床干预,行支气管镜检查,如支气管镜结果为阴性,建议进入下年度LDCT筛查;如为阳性,建议多学科会诊后决定是否进行临床治疗或进入下年度HRCT筛查。
(2)如筛查结果为阴性或上年度检出结节无变化,建议进入下年度LDCT筛查。
(3)如上年度检出结节增大或实性成分增多,建议进行临床诊疗。(4)检出新发非钙化结节,如结节平均长径<5 mm,建议6个月后复查HRCT,如结节未增大,建议进入下年度筛查;如增大,建议多学科会诊后决定是否进行临床治疗或进入下年度筛查。如结节平均长径≥5 mm,建议抗感染治疗或随访,3个月后复查HRCT,如结节完全吸收,建议进入下年度筛查;如结节部分吸收,6个月后复查HRCT,如继续吸收或完全吸收,建议进入下年度筛查;如无变化或增大,建议多学科会诊后决定是否进行临床治疗。
3.多发结节的管理
对于多发结节的随访频率应基于最大/最可疑的结节进行评估,且每个结节应独立进行评估,除非病理学明确为转移。对于高度怀疑转移性病灶应考虑进行病理学活检。条件允许的情况下可对多个病灶进行病理学评估。对于患者因多发结节导致治疗方案选择困难时,建议采用多学科讨论方式确定治疗方案。
4.假阳性与过度诊断
尽管肺癌筛查可降低肺癌死亡率,但筛查仍存在一些潜在的危害,如假阳性结果,可导致不必要的有创检查,并进一步导致过度诊断和过度治疗。尤其2021版WHO肺肿瘤组织学分型已将原位腺癌(adenocarcinoma in situ, AIS)和肺不典型腺瘤样增生(atypical adenomatous hyperplasia, AAH)归入腺样前体病变,因此对于筛查发现肺部结节的处理更应谨慎。因此,建议筛查机构通过完整的说明及介绍使筛查人群充分了解肺癌筛查的益处、局限性和潜在的危害。
5.参与度与依从性
肺癌筛查中,高危人群的参与度与依从性是保证筛查顺利实施的重要因素,近年来越来越被重视。建议通过患教及科普等形式提高社区居民对筛查的认识,以保证较高的筛查参与度与依从性。
6.戒烟建议
在肺癌筛查中建议开展戒烟宣传教育,对每位吸烟的筛查对象都应建议戒烟,必要时可建议戒烟门诊就诊,以提供相应的医疗干预及药物治疗。同时,告知筛查不应被视为戒烟的替代措施。
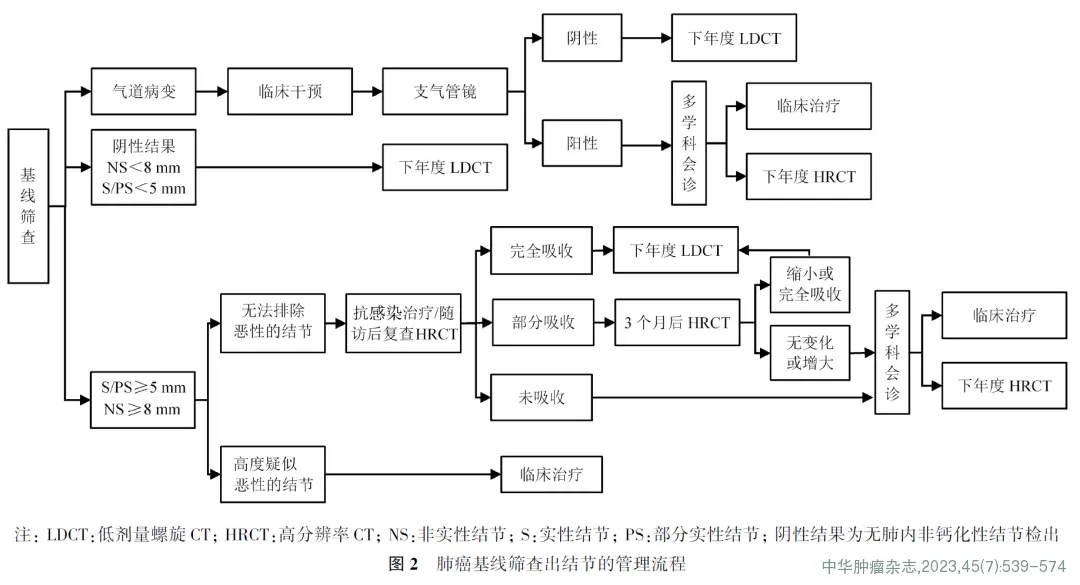
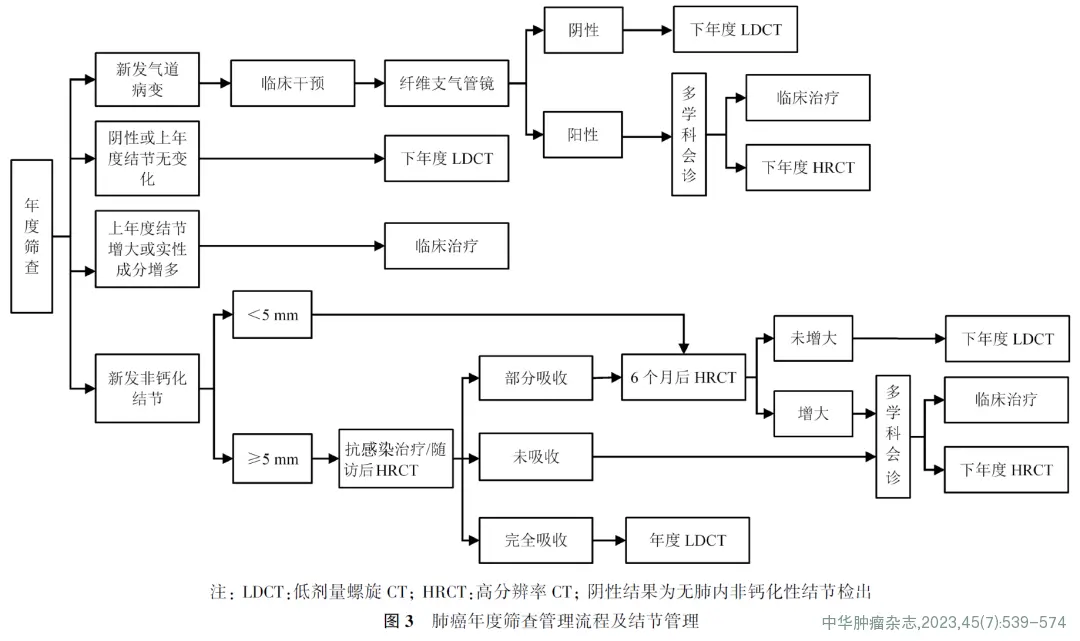
肺癌筛查的人群选择见图1,基线筛查出肺结节管理流程见图2,年度筛查肺结节管理流程见图3。

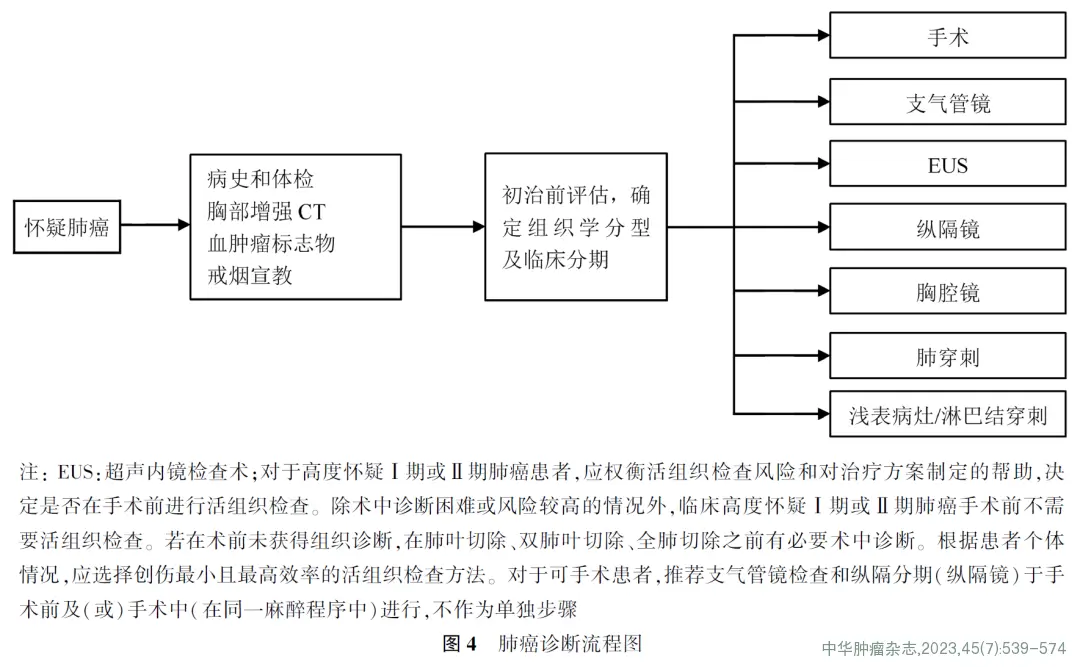
二肺癌的诊断肺癌诊断流程见图4。
(一)肺癌的临床表现
中央型肺癌可表现出相应的临床症状及体征,包括咳嗽、咳痰、咯血、喘鸣、胸闷、气急、胸痛、声音嘶哑、吞咽困难、上腔静脉综合征、膈肌麻痹、胸腔和心包积液、Pancoast综合征等。远处转移可因转移部位不同而出现不同的局部和全身症状。周围型肺癌早期常无呼吸道症状,随着病情的发展,可出现相应的呼吸道症状或转移相关症状。少数肺癌患者可出现一些少见的并非由肿瘤直接侵犯或转移引起的症状和体征,又称副癌综合征,常表现为胸部以外的脏器相关症状,如高钙血症、抗利尿激素分泌异常综合征、异位库欣综合征、神经肌肉功能异常、血液系统异常等。
(二)肺癌的辅助影像学检查
肺癌的诊治过程中,建议根据不同的检查目的,合理、有效地选择1种或多种影像学检查方法。
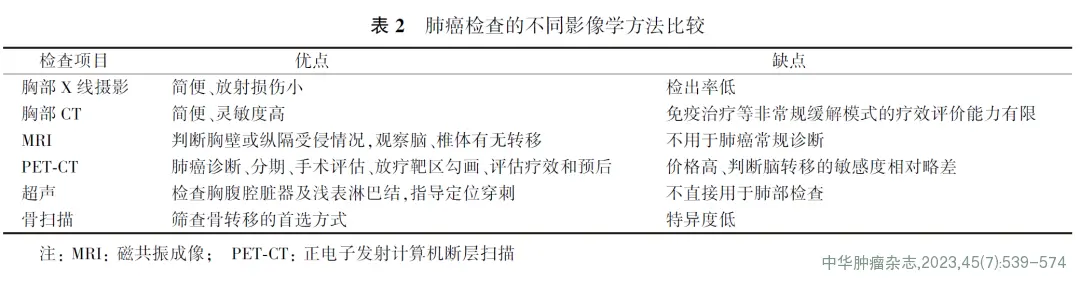
肺癌的医学影像学检查方法主要包括X线摄影、CT、磁共振成像(magnetic resonance imaging, MRI)、正电子发射计算机断层扫描(positron emission tomography-computed tomography, PET-CT)、超声、核素显像等方法。影像学检查主要用于肺癌诊断、分期、疗效监测、再分期及预后评估等。
1.胸部X线摄影
胸部X线摄影是胸部的基本检查方法,通常包括胸部正、侧位片。发现胸部X线影像异常时,应有针对性地选择进一步的影像检查方法。虽然X线摄影空间分辨率较高,但是密度分辨率低于CT,目前多用于入院常规检查或胸部术后复查等。
2.胸部CT
胸部CT可有效检出早期周围型肺癌、明确病变所在的部位和累及范围,是目前肺癌诊断、分期、疗效评价和随诊的主要影像学检查手段。
CT检查的优势:(1)密度分辨率高,可检出长径仅2 mm以上的微小结节及胸部X线摄影时隐秘或重叠区部位(如心影后、横膈上、纵隔旁、锁骨及肋骨投影区下)的病灶;(2)容积采集,通过CT,特别是HRCT薄层重组和三维重建可全面分析并发现对良恶性肿瘤有鉴别意义的影像学特征,也有助于精准随访;(3)对比剂增强检查可提供功能信息和全面评估。使用对比剂除了可提高病灶的定性能力、显示实性病灶的血供情况,还可帮助检出、区分血管和肺门及纵隔有无增大淋巴结,对做出更准确的肺癌临床分期和疗效评价、判断手术切除的可能性等有重要意义。
3.MRI检查
MRI一般不用于肺癌的常规检查,但可选择性用于以下情况:判断胸壁或纵隔受侵情况,显示肺上沟瘤与臂丛神经及血管的关系,长径>8 mm疑难实性肺结节的鉴别诊断等。MRI检查在肺癌精准疗效评价中有重要潜在价值。另外,推荐使用增强MRI检查判定有无脑转移和局部骨转移。
4.PET-CT检查
PET-CT是诊断肺癌、分期与再分期、手术评估、放疗靶区勾画(尤其合并肺不张或有静脉CT造影禁忌证时)、疗效和预后评估的最佳方法之一。PET-CT对于脑和脑膜转移诊断的敏感度相对较差,必要时需与脑部增强MRI联合诊断以提高检出率。推荐有条件者进行PET-CT检查。
5.超声检查
超声检查一般不用于肺癌的常规检查,常用于检查腹部脏器及浅表淋巴结有无异常,对浅表淋巴结、邻近胸壁的肺内病变或胸壁病变可进行超声引导下穿刺活检,还可用于检查有无胸腔积液及心包积液,并可进行超声定位抽取积液。
6.骨扫描
骨扫描是判断肺癌骨转移的常规检查,是筛查骨转移的首选方式。当骨扫描检查发现可疑骨转移时,可行MRI检查等进一步确认。
对肺癌患者进行分期诊断时,有条件者可进行PET-CT和头部增强MRI检查,亦可根据当地情况进行胸部增强CT、腹部增强CT或超声(检查范围需包括锁骨上淋巴结)、头部增强CT或MRI、全身骨扫描检查。不同影像学检查方法的优缺点见表2。
(三)获取肺癌细胞学或组织学检查技术
获取病理学标本时,若条件允许,除细胞学取材外,建议尽可能获取组织标本,除用于诊断外,还可以进行基因检测。
1.痰液细胞学检查
痰液细胞学检查是诊断中央型肺癌最简单方便的无创诊断方法,但有一定的假阳性和假阴性可能,且分型较为困难。
2.胸腔穿刺术
胸腔穿刺术可以获取胸腔积液进行细胞学检查,以明确病理和进行肺癌分期。胸腔积液离心沉淀的细胞块行石蜡包埋、切片和染色,可提高病理阳性诊断率。对位于其他部位的转移性浆膜腔积液亦可行穿刺获取病理证据。
3.浅表淋巴结和皮下转移病灶活组织检查
对于肺部占位怀疑肺癌者,如发现浅表皮下病灶或浅表淋巴结肿大,可进行活检以获得病理学诊断。
4.经胸壁肺穿刺术
在CT或超声引导下经胸壁肺穿刺是诊断周围型肺癌的首选方法之一。
5.支气管镜检查
支气管镜检查是肺癌的主要诊断工具之一。支气管镜可进入4~5级支气管,帮助肉眼观察近端约1/3的支气管黏膜,并通过活检、刷检以及灌洗等方式进行组织学或细胞学取材,活检、刷检以及灌洗联合应用可以提高检出率。常规支气管镜检查的不足主要包括:(1)检查范围有限,对于外周2/3的呼吸道无法进行肉眼观察;(2)对于支气管腔外病变及淋巴结等无法直接观察;(3)对于呼吸道黏膜上皮异型细胞增生及原位癌的诊断率不高。荧光支气管镜是利用肿瘤组织的自体荧光特性有别于正常组织这一原理开发出的气管镜检查技术,联合常规气管镜检查可明显提高对上皮细胞癌变和浸润性肺癌的诊断。对于常规支气管镜无法观察到的病灶,可根据病灶的部位和不同单位的具体条件,通过细或超细支气管镜、X线透视、径向超声探头、电磁导航支气管镜等引导支气管镜技术以获得病理结果。
6.经支气管镜针吸活检术(transbronchial needle aspiration, TBNA)和超声支气管镜引导下经支气管针吸活检术(endobronchial ultrasound-guided transbronchial needle aspiration, EBUS-TBNA)
传统TBNA根据胸部病灶CT定位操作,对术者技术要求较高,不作为常规推荐的检查方法,有条件的医院可开展。EBUS-TBNA可在超声引导下实时行胸内病灶及纵隔、肺门淋巴结转移灶穿刺,更具安全性和可靠性,建议有条件的医院积极开展。当临床医师怀疑纵隔和肺门淋巴结转移而其他分期手段难以确定时,推荐采用EBUS-TBNA等有创手段明确纵隔淋巴结状态。
7.纵隔镜检查
纵隔镜检查取样较多,是鉴别伴纵隔淋巴结肿大的良恶性疾病的有效方法,也是评估肺癌分期的方法之一,但操作创伤及风险相对较大。
8.胸腔镜
内科胸腔镜可用于不明原因的胸腔积液、胸膜疾病的诊断。外科胸腔镜可有效地获取病变肺组织,对于经支气管镜和经胸壁肺穿刺术等检查方法无法取得病理标本的肺癌,尤其是肺部微小结节病变,通过胸腔镜下病灶切除,即可明确诊断。对考虑为中晚期肺癌的患者,在其他检查方法无法明确病理的情况下,也可以采用胸腔镜行肺内病灶、胸膜活组织检查,为制定全面治疗方案提供可靠依据。
(四)肺癌的血清学实验室检查
血清学检查有助于肺癌的辅助诊断、疗效判断和随访监测。
目前推荐常用的原发性肺癌标志物有癌胚抗原(carcinoma embryonic antigen, CEA)、神经元特异性烯醇化酶(neuron-specific enolase, NSE)、细胞角蛋白19片段抗原(cytokeratin 19 fragment antigen21-1, CYFRA21-1)、胃泌素释放肽前体(pro-gastrin-releasing peptide, ProGRP)、鳞状上皮细胞癌抗原(squamous cell carcinoma antigen, SCCA)等。肿瘤标志物联合检测可提高其在临床应用中的灵敏度和特异度。
肺癌的诊断通常需要结合影像学和病理学检查。虽然肺癌血清肿瘤标志物的灵敏度和特异度不高,但其升高有时可早于临床症状的出现。因此,检测肺癌相关的肿瘤标志物,有助于辅助诊断和早期鉴别诊断并预测肺癌病理类型。肿瘤标志物水平与肿瘤负荷和分期有一定关联,推荐在首次诊断及开始治疗前行肿瘤标志物检测了解其基线水平,监测治疗后动态变化可在肿瘤的疗效和预后判断中发挥一定作用。在对肿瘤患者长期监测过程中,改变肿瘤标志物检测方法可导致结果差异,因此,不同检测方法的肿瘤标志物结果不宜直接比较。注意排除饮食、药物、合并疾病等其他因素对检测结果的影响。对于影像学检查无明确新发或进展病灶而仅仅肿瘤标志物持续升高的患者,建议寻找原因,警惕有疾病复发或进展的可能,需密切随访。
1.SCLC
NSE和ProGRP是诊断SCLC的首选指标。NSE由中枢或外周神经元以及神经外胚层性肿瘤分泌,当组织学结果无法确诊时,NSE可以辅助支持SCLC的诊断;溶血会显著影响NSE检测结果,应在60 min内与红细胞分离检测,防止假性升高。ProGRP作为单个标志物对SCLC诊断的特异度优于其他标志物,且与SCLC分期呈正相关,有助于鉴别SCLC和良性肺部疾病。ProGRP浓度升高也会出现在肾功能不全的患者中,其水平与血清肌酐有关,因此,当ProGRP水平升高而与患者临床症状不相符时,应首先评估患者的血清肌酐水平。
2.非小细胞肺癌(non-small cell lung cancer, NSCLC)
在患者的血清中,CEA、SCCA和CYFRA21-1水平的升高有助于诊断NSCLC。CEA在肺腺癌和非神经内分泌大细胞肺癌中升高最为明显,且灵敏度较高。但需注意CEA增高还可见于消化道肿瘤和肺间质纤维化等。联合检测CYFRA21-1和CEA可以提高对肺腺癌诊断的灵敏度和特异度。长期吸烟人群CEA水平可能略高于健康人群。CYFRA21-1也是NSCLC的敏感指标之一,应注意外伤和唾液污染以及在肾功能衰竭的患者中CYFRA21-1可能会出现假性升高。SCCA对鳞状上皮肿瘤如肺鳞状细胞癌有较高的特异度,可以辅助组织学诊断。然而,单一的标志物并不能鉴别SCLC和NSCLC。约10%的NSCLC对神经内分泌标志物中至少1种存在免疫反应。若联合检测NSE、ProGRP、CYFRA21-1、CEA和SCCA等指标,可提高鉴别准确率。
三肺癌的病理学评估(一)病理学亚型
1.病理学评估
病理学评估的目的在于明确病变性质并为临床病理分期提供相关信息,同时还包括分子检测标本的质量控制。病理学评估标本类型包括活检标本、细胞学标本、手术切除标本及拟进行分子检测的其他标本。
(1)活检标本或细胞学标本:①依据2021年版WHO分类准确诊断,病理诊断同时尽可能保留足够标本进行分子生物学和免疫治疗相关检测(1类推荐证据)。②治疗后疾病进展的患者再次活检时,在明确组织类型前提下,根据诊治需求做相应的分子病理检测(2A类推荐证据)。③争取明确组织亚型,当标本无明显分化或表型特征时才可诊断非小细胞癌非特指型(non-small cell carcinoma-not otherwise specified, NSCC-NOS;2A类推荐证据)。④对于细胞学标本,尽可能同时制作细胞蜡块(2B类推荐证据)。
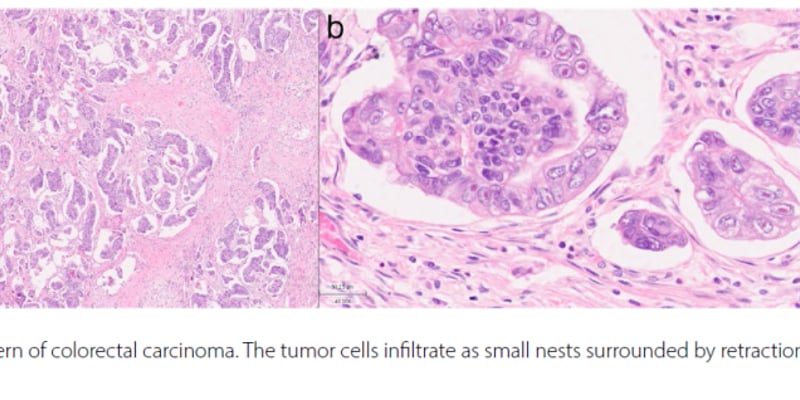
(2)手术切除标本:手术切除标本用于明确肿瘤的性质和组织类型、肿瘤分期、分子病理检测和预后相关信息,包括肿瘤大小、周围组织侵犯情况、手术切缘及淋巴结转移等(2A类推荐证据)。①淋巴结转移数目及部位需要在报告内详细标明,原发肿瘤浸润至邻近淋巴结应诊断为淋巴结转移;②可疑胸膜侵犯时应使用弹力纤维特殊染色进一步证实;③气腔内播散(spread through air spaces, STAS)建议在报告中注明(2B类推荐证据);④对肿瘤大小以及肿瘤与手术切缘、周围组织等的距离应当进行准确测量,测量精度为mm;⑤对于肺内多发病灶,建议按照国际分类标准推荐的方法评估各病灶的关系。
(3)新辅助治疗后肺癌手术切除标本病理评估:NSCLC采用新辅助治疗(如化疗、放化疗、分子靶向治疗、免疫治疗或未来新疗法,单药或者联合给药),病理学评估能够较准确反映临床疗效,是新辅助治疗后疗效评估的重要方法。对所有带瘤床的切片采用半定量评估方法综合评估瘤床内的主要成分百分比,目前推荐评估3种主要成分,包括残存活肿瘤细胞、坏死和间质(间质主要为纤维组织和炎性病变),3种成分之和为百分之百。主要病理缓解是指新辅助治疗后肿瘤床内的残存活肿瘤细胞的百分比≤10%,无论淋巴结内有无活肿瘤细胞残存;病理完全缓解是指新辅助治疗后瘤床内和淋巴结内均无残存活肿瘤细胞。目前,对于淋巴结病理反应评估的临床意义尚不明确。
NSCLC新辅助治疗后病理分期采用美国癌症联合会第8版TNM分期系统,T分期中肿瘤大小调整为残存肿瘤的大小。N分期需要根据淋巴结内有无肿瘤细胞归入相应N分期。
2.病理组织学类型
组织学分型采用2021年版WHO肺肿瘤组织学分型标准。
(1)组织标本诊断原则(2A类推荐证据)
①鳞状细胞癌:鳞状细胞癌是出现角化和(或)细胞间桥或表达鳞状细胞分化标志的上皮性恶性肿瘤。鳞状细胞癌分为鳞状细胞癌、非特指(包括角化型、非角化型和基底样鳞癌)和淋巴上皮癌。淋巴上皮癌为低分化的鳞状细胞癌伴有数量不等的淋巴细胞、浆细胞浸润,EB病毒常常阳性,需注意与鼻咽癌鉴别。鳞状非典型增生和原位鳞状细胞癌为鳞状前体病变。
②腺癌:腺癌包括微浸润性腺癌(minimally invasive adenocarcinoma, MIA)、浸润性非黏液腺癌、浸润性黏液腺癌、胶样腺癌、胎儿型腺癌和肠型腺癌。MIA是指肿瘤以贴壁型成分为主,且浸润成分最大径≤5 mm。MIA肿瘤大小≤30 mm且均无胸膜、支气管、脉管侵犯、肿瘤性坏死以及STAS。肺浸润性非黏液腺癌为形态学或免疫组织化学具有腺样分化的证据。常见亚型包括贴壁型、腺泡型、乳头型、微乳头型和实体型,常为多个亚型混合存在。病理诊断按照各亚型所占比例从高至低依次列出,各种亚型所占比例以5%为增量。长径>30 mm的非黏液型纯贴壁生长的肺腺癌应诊断为贴壁型浸润性非黏液腺癌。早期浸润性非黏液性腺癌分级方案由国际肺癌研究协会(International Association for Study of Lung Cancer, IASLC)病理委员会提出。根据腺癌中占优势的组织学类型以及高级别结构的占比分成3级:1级为高分化,2级为中分化,3级为低分化。高分化为贴壁为主型无高级别成分,或者伴有<20%高级别成分;中分化为腺泡或乳头为主型无高级别成分,或者伴有<20%高级别成分;低分化为任何组织学类型腺癌伴有≥20%的高级别成分。高级别结构包括实体型、微乳头型、筛孔、复杂腺体结构(即融合腺体或单个细胞在促结缔组织增生的间质中浸润)。AIS指单纯贴壁生长模式的腺癌,AIS和AAH被归入腺体前驱病变。
③腺鳞癌:指含有腺癌和鳞状细胞癌2种成分,每种成分占全部肿瘤占比≥10%。
④神经内分泌肿瘤:包括神经内分泌瘤(neuroendocrine tumors, NETs)和神经内分泌癌(neuroendocrine carcinomas, NECs);其中NETs包括典型类癌(typical carcinoid, TC)、不典型类癌(atypical carcinoid, AC),NECs包括SCLC、大细胞神经内分泌癌(large cell neuroendocrine carcinoma, LCNEC)。SCLC转化也可以是表皮生长因子受体(epidermal growth factor receptor, EGFR)突变或其他NSCLC驱动基因突变酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)治疗后的耐药机制之一。复合型SCLC是指SCLC合并NSCLC的任何一种组织学类型。合并大细胞并且大细胞成分占比≥10%时,诊断为复合型SCLC/LCNEC或SCLC/大细胞癌,合并其他NSCLC无比例要求。复合型LCNEC指LCNEC伴其他NSCLC成分。核分裂及坏死指标是区分4种神经内分泌肿瘤类型的主要病理指标(2A类推荐证据)。Ki-67指数在小活检标本中鉴别NETs和NECs有帮助(2B类推荐证据)。神经内分泌标志物仅用于形态学怀疑神经内分泌肿瘤的病例。
类癌非特指适用于TC和AC不易区分的情况,建议标注核分裂数、有无坏死以及Ki-67指数。类癌非特指主要应用于以下情况:一些小活检或细胞学标本由于组织有限难以区分TC或AC;肺转移性类癌;一些手术标本没有提供肿瘤组织全部切片。
类癌具有高核分裂数和/或Ki-67增殖指数,指具有AC形态特点,但具有更高的核分裂数(>10个/2 mm2)和/或Ki-67增殖指数高于预期(>30%),通常被归类到LCNEC,对应胰腺NET-G3,但该类肿瘤的预后不同于经典LCNEC。建议对于具有上述特点的类癌诊断时加以备注核分裂数和/或Ki-67增殖指数。
4种神经内分泌肿瘤特点见表3。

⑤大细胞癌:大细胞癌为一种未分化非小细胞癌,在细胞形态、组织结构、免疫组织化学方面缺乏小细胞癌、鳞状细胞癌、腺癌以及巨细胞癌、梭形细胞癌、多形性癌的特点,是排除性诊断。
⑥肉瘤样癌:肉瘤样癌包括多形性癌、癌肉瘤和肺母细胞瘤等,多形性癌是包含至少10%梭形或巨细胞成分的NSCLC,或完全为梭形细胞癌或巨细胞癌成分。癌肉瘤是混合肉瘤成分的NSCLC。肺母细胞瘤包含低级别胎儿型腺癌及原始间充质成分的双向分化性肿瘤。
⑦其他上皮源性肿瘤:胸部SMARCA4缺失未分化肿瘤(SMARCA4-deficient undifferentiated tumor, SMARCA4-UT)是一种高级别恶性肿瘤,主要累及成年人胸部,具有显著男性倾向,多发生在重度吸烟者,并且具有吸烟相关基因改变,组织学表现为未分化或横纹肌样表型并伴有SMARCA4缺失。SMARCA4-UT多呈侵袭性生长,预后差,通常对细胞毒性化疗无效。约5%~10%的经典NSCLC以及部分TTF-1阴性的NEC(SCLC和LCNEC)存在SMARCA4表达缺失,其临床意义有待进一步研究。NUT癌为一种低分化癌,组织学表现为单一形态的小-中等大小未分化细胞,伴有突然角化。肿瘤有15q14的NUTM1基因重排,表达睾丸核蛋白(nuclear protein in testis, NUT)。NUT癌极具侵袭性,临床易误诊,通常对细胞毒性药物化疗疗效欠佳,部分研究支持免疫治疗联合化疗存在一定价值,靶向BRD4的BET小分子抑制剂治疗NUT癌的临床研究正在进行中。其他少见类型请参阅2021年版WHO分类。
⑧转移性肿瘤:肺是全身肿瘤的常见转移部位,应注意除外转移性肿瘤。免疫组织化学有助于鉴别组织来源,如肺(TTF-1和Napsin A)、乳腺(GCDFP15、Mammaglobin和GATA-3)、肾细胞癌(PAX8和RCC)、胃肠道(CDX2和Villin)、前列腺(NKX3.1和前列腺特异性抗原)和间皮(WT-1、Calretinin、D2-40和GATA-3)等(2A类推荐证据)。
(2)细胞学标本诊断原则(2A类推荐证据)
①尽可能少使用NSCC-NOS的诊断;②当有配对的细胞学和活组织检查标本时,应综合诊断以达到一致性;③肿瘤细胞或可疑肿瘤细胞的标本,均应尽可能制作细胞学蜡块;④细胞学标本分型不建议过于细化,仅作腺癌、鳞状细胞癌、神经内分泌癌或NSCC-NOS分型即可。
(二)免疫组织化学检测(2A类推荐证据)
1.原则
对于小活检标本谨慎使用免疫组织化学染色,以便保留组织用于治疗相关检测。
2.神经内分泌标志物
常用神经内分泌标志物抗体包括Syn、CgA、CD56和INSM1,转录因子ASCL1、NEUROD1和POU2F3对于NECs的诊断有帮助,特别是在经典神经内分泌标志物阴性的情况下(2B类推荐证据)。大部分SCLC有RB蛋白丢失和p53过表达或不表达。Ki-67是鉴别SCLC和不典型类癌的重要指标,尤其是针对难以计数核分裂的小活检标本,Ki-67在SCLC中一般为30%~100%,在类癌中<30%。
3.形态学不明确的肺癌
活检标本使用1个腺癌标志物TTF-1和1个鳞状细胞癌标志物(P40)可以解决绝大部分NSCLC的分型问题。对于手术标本:(1)使用一组抗体鉴别腺癌、鳞状细胞癌;(2)当出现神经内分泌形态时,用一组分子标志物证实神经内分泌分化;(3)对于分化差的癌或恶性肿瘤,可行NUT、SMARCA4(BRG-1)和(或)INI-1、SOX-2等免疫组化检测,以除外NUT癌、SMARCA4-UT等少见组织学类型;(4)对于具有明显淋巴细胞浸润的低分化癌或非角化型鳞癌进行EBER原位杂交检测。
4.晚期NSCLC
对于晚期NSCLC,与驱动基因检测同样重要的是应检测程序性死亡配体1(programmed death ligand-1, PD-L1)的表达情况(2A类推荐证据)。
(三)分子病理学检测
1.标本类型
除酸处理的标本外,甲醛固定、石蜡包埋标本、细胞块和细胞涂片均适用于分子检测。所有待检测组织学和细胞学标本需经过病理医师质控,评估肿瘤类型、细胞含量、坏死率,筛选适合分子检测的组织学类型,并确保有足量肿瘤细胞提取DNA或RNA(1类推荐证据)。如具备条件可进行肿瘤富集操作(2A类推荐证据)。
2.基本原则
(1)尽量保留足够组织进行分子检测:标本常规组织学诊断后尽量保留足够组织进行分子生物学检测,根据分子分型指导治疗(1类推荐证据);晚期NSCLC组织学诊断后需保留足够组织进行分子生物学检测,根据分子分型指导治疗(2A类推荐证据)。
(2)含腺癌成分的NSCLC分子检测说明:含腺癌成分的NSCLC,无论其临床特征(如吸烟史、性别、种族或其他等),应常规行EGFR、间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)重排、ROS1重排、BRAF V600突变、RET重排、MET14外显子跳跃突变、NTRK1/2/3重排的分子生物学检测(1类推荐证据),ⅠB~Ⅲ期术后患者手术病理标本需常规行EGFR突变检测(1类推荐证据)。检测方法应选择经国家官方批准的试剂和平台设备,也可使用获官方批准的二代测序(next generation sequencing,NGS)检测试剂平台。组织有限和(或)不足以进行分子生物学检测时,可利用血浆游离DNA检测EGFR突变(2A类推荐证据)。
(3)NSCLC推荐必检基因:NSCLC推荐检测必检基因为EGFR、ALK、ROS1、RET、BRAFV600和MET14外显子跳跃突变、KRAS、NTRK(1类推荐证据),扩展基因为包括MET扩增或过表达、HER-2等(2A类推荐证据)。采用经过验证的NGS平台或RT-PCR多基因联检平台可同时检测全部必检基因和扩展基因;若组织标本不可及,可考虑利用血浆循环肿瘤DNA(circulating tumor DNA, ctDNA)进行检测(2B类推荐证据)。
(4)耐药后基因检测:对于EGFR-TKI耐药患者,建议二次活组织检查进行继发耐药基因检测:①EGFR T790M检测;对于无法获取组织的患者,可用ctDNA行EGFR T790M检测(2A类推荐证据)。当ctDNA阴性时,仍应建议患者行组织检测以明确EGFR T790M突变状态。②MET扩增检测(2B类推荐证据)。
原发肿瘤和转移病灶均适于靶向驱动基因检测(1类推荐证据)。
(5)肿瘤免疫治疗患者的筛选方法:①免疫组化检测NSCLC的PD-L1表达情况可发现可能对免疫治疗有效的患者。免疫组化检测PD-L1有多种克隆号的抗体,对应不同的治疗药物,判定标准需参阅各试剂盒的使用说明,负责诊断的病理医师须通过相应的判读培训(2B类推荐证据)。②肿瘤突变负荷(tumor mutation burden, TMB)可能是预测免疫治疗效果的又一标志物。目前,在TMB检测方法及阈值的选择上还无统一的标准(3类推荐证据)。
四肺癌的分期治疗原则外科手术根治性切除是Ⅰ、Ⅱ期NSCLC的推荐优选局部治疗方式。
Ⅲ期NSCLC是一类异质性明显的肿瘤。根据国际肺癌研究学会第8版,Ⅲ期NSCLC分为ⅢA期、ⅢB期、ⅢC期。ⅢC期和绝大部分ⅢB期归类为不可切除的Ⅲ期NSCLC,治疗以根治性同步放化疗为主要治疗模式(1类推荐证据)。ⅢA期和少部分ⅢB期NSCLC的治疗模式分为不可切除和可切除。对于不可切除者,治疗以根治性同步放化疗为主;对于可切除者,治疗模式为以外科为主的综合治疗(2A类推荐证据)。
Ⅳ期NSCLC患者的全身治疗建议在明确患者NSCLC病理类型(鳞或非鳞)和驱动基因突变状态并进行美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)功能状态(performance status, PS)评分(表4)的基础上,选择适合患者的全身治疗方案。

五肺癌的治疗(一)Ⅰ、Ⅱ期NSCLC患者的综合治疗(图5)

1.基本原则
根治性外科手术切除(解剖性肺切除和纵隔淋巴结清扫或采样)是早期NSCLC的推荐首选局部治疗方式。
2.外科治疗的重要性
外科医师应积极参与对患者临床分期、切除可能性的判断和功能评估,根据肿瘤进展程度和患者的功能状况决定手术指征和手术方式。高危患者身体功能状况可能无法耐受根治性手术切除时,应首先由包括外科医师在内的多学科团队进行讨论,决定其他局部治疗方式,如立体定向放疗(stereotactic body radiotherapy, SBRT)、冷冻和射频消融等。
3.手术方式
(1)原则:完整彻底切除是保证手术根治性、分期准确性、加强局控和长期生存的关键。驱动基因阴性可切除的NSCLC可使用化疗或纳武利尤单抗联合含铂双药化疗进行新辅助治疗(肿瘤≥4 cm或淋巴结阳性,1类推荐证据)。
(2)手术方式:解剖性肺切除仍是标准术式(1类推荐证据)。LCSG821前瞻性研究结果显示,T1期肺癌肺叶切除的局部复发率明显低于亚肺叶切除,生存率显著高于亚肺叶切除,因此,目前早期肺癌的标准术式仍为解剖性肺叶切除(1类推荐证据)。对于部分中央型肺癌,在手术技术能够保证切缘的情况下,支气管和(或)肺动脉袖式肺叶切除围手术期风险小而疗效优于全肺切除,为推荐术式(1类推荐证据)。亚肺叶切除:①解剖性肺段切除:CALGB140503是对外周型ⅠA期NSCLC亚肺叶切除对比肺叶切除的前瞻性随机对照临床研究,结果显示,对于肿瘤长径2 cm以内的NSCLC,在证实了肺门和纵隔淋巴结阴性后,亚肺叶切除5年无病生存率和5年生存率与肺叶切除比较差异无统计学意义,并且亚肺叶切除患者术后半年肺功能保留较之肺叶切除有所提高。JCOG0802早期肺癌肺叶切除与肺段切除比较的前瞻性结果显示,对于≤2 cm、薄层扫描CT上实性成分占比(consolidation tumor ratio, CTR)>0.5的早期肺癌,肺段切除组除了肺漏气外与肺叶切除组围术期并发症几乎无差异;术后肺功能的保留肺段切除组优于肺叶切除组,但未达到试验设计要求达到10%以上的差异;无复发生存肺段切除组与肺叶切除组无显著差异,总生存肺段切除优于肺叶切除(可能是肺叶切除组第二原发肿瘤死亡高于肺段切除组引起),但是肺段切除组局部复发率高于肺叶切除组。肺段切除在保留肺功能及生存率上是否优于肺叶切除,尚需要其他前瞻性临床试验结果证实。JCOG1211是一项前瞻性、多中心、单臂、确证性Ⅱ期临床研究,旨在分析长径3 cm以内、CTR 0.5以下的磨玻璃(ground-glass opacity, GGO)为主的临床ⅠA期肺癌行肺段切除的疗效,研究结果显示,患者的5年无复发生存率和5年生存率均达到98%。此外肺段切除术的围手术期安全性良好,JCOG1211肺段切除手术在术后半年及1年的肺功能保留均优于JCOG0802中肺叶切除手术患者。鉴于以上3项大型前瞻性临床研究,肺段切除应为病灶位于肺外周1/2、长径≤2 cm、含GGO成分早期肺癌可以接受的手术方式。目前意向性肺段切除可适用于以下情况(1类推荐证据):(a)患者功能状况无法耐受肺叶切除;(b)肿瘤长径≤2 cm的周围型小结节、同时具备以下条件之一:原位癌;GGO成分超过50%;长期随访提示倍增时间超过400 d;(c)肺段切除要求:应保证切缘≥2 cm或≥病灶长径;除非患者功能状况不允许,否则同样应行肺门、纵隔淋巴结采样,尤其是实密成分较多的GGO结节(2A类推荐证据)。②楔形切除:影像学上以GGO表现为主的肺结节大多为非浸润性肺癌。JCOG0804前瞻性多中心单臂临床试验结果显示,对于≤2 cm、薄层扫描CT上GGO为主CTR≤0.25(亦即按照第8版IASLC肺癌分期Tis或Tmi)的早期肺癌,手术方式以楔形切除为主(82%),非浸润性肺癌占97.7%,5年无复发生存率达到99.7%,且无局部复发事件。CALGB140503研究中,亚肺叶切除组中肺楔形切除占比近60%,亚肺叶切除组5年无复发生存率和5年总生存率均与肺叶切除组差异无统计学意义。故在肺门及纵隔淋巴结评估阴性的情况下,肺楔形切除可以用于外周型肿瘤长径2 cm以内的NSCLC。因此,意向性楔形切除手术可作为以下情况推荐(2B类推荐证据):(a)病灶位于肺外周1/3;长径≤2 cm的小结节;实密成分≤0.5 cm;实性成分较多的病灶需先行纵隔和肺门淋巴结分期;(b)楔形切除要求:应保证肉眼可见切缘>5 mm,若不足5 mm,需冰冻切片证实切缘阴性。
(3)手术路径:开胸和微创手术具备同样的肿瘤学效果,外科医师可根据习惯和熟练程度选择手术方式(1类推荐证据)。已证实胸腔镜(包括机器人辅助)等微创手术安全可行,围手术期安全性优于开胸手术,长期疗效不亚于开胸手术。因此,在技术可行且不牺牲肿瘤学原则的前提下推荐胸腔镜手术路径(1类推荐证据)。
(4)淋巴结清扫标准(2A类推荐证据):淋巴结清扫及采样是外科手术的必要组成部分,常规至少应整块清除或系统采样3组纵隔淋巴结(左侧:第4L、5、6、7、8、9组,右侧第2R、4R、7、8、9组)。对于淋巴结清扫或采样数目,至少清扫或采样纵隔+肺内共12个淋巴结。Ⅰ~Ⅲ期肺癌在术前规范纵隔分期未发现淋巴结转移(PET-CT或EBUS、纵隔镜检查阴性)的前提下,淋巴结清扫较采样并未明显升期或带来术后生存优势,但术前仅行常规影像分期(未行PET或EBUS、纵隔镜分期)者,仍推荐行淋巴结清扫(1类推荐证据)。术前影像学显示纯GGO为主(成分>50%)且术中冰冻为伏壁生长为主的MIA或者T1a病灶,纵隔淋巴结转移概率极低,可选择性采样1~3组(左侧第4、5、7组,右侧第2、4、7组)纵隔淋巴结。
4.手术切除标准
完整切除包括阴性切缘(支气管、动脉、静脉、支气管周围、肿瘤附近组织)。无论何时,如有出现切缘受累、未切除的阳性淋巴结、淋巴结外侵犯或转移性胸腔积液或心包积液,即为不完整切除。完整切除为R0,镜下发现不完整切除或淋巴结包膜外浸润为R1,肉眼可见肿瘤残余为R2。根据IASLC发表的R-un切除定义,R-un定义为如下情况:(1)清除少于3枚N1或少于3枚N2淋巴结;(2)清扫范围未达到肺叶特异性淋巴结清扫标准;(3)最高纵隔组送检淋巴结阳性;(4)支气管切缘原位癌变;(5)胸膜腔灌洗细胞学阳性。
5.术后辅助治疗
(1)完整切除切缘阴性(R0切除)NSCLC后续治疗:①ⅠA(T1a/b/cN0)期患者术后定期随访(1类推荐证据)。②ⅠB(T2aN0)期患者术后可随访。ⅠB期患者术后辅助治疗需行多学科评估,对每例患者评估术后辅助化疗的益处与风险。有高危因素者[如低分化肿瘤(包括神经内分泌肿瘤但不包括分化良好的神经内分泌肿瘤)、脉管侵犯、脏层胸膜侵犯、STAS、姑息性切除]推荐进行术后辅助化疗(2A类推荐证据)。病理亚型以实体型或微乳头为主的ⅠB期腺癌患者也可考虑辅助化疗(2B类推荐证据)。③ⅡA/ⅡB期患者,推荐以铂类为基础的方案进行辅助化疗,不建议行术后辅助放疗(1类推荐证据)。④ⅠB~Ⅱ期术后发现EGFR敏感基因突变的患者,可行奥希替尼辅助靶向治疗(1类推荐证据)。ⅡA~Ⅲ期术后发现EGFR敏感基因突变的患者,可行埃克替尼辅助靶向治疗(1类推荐证据)。ⅡA~Ⅲ期术后驱动基因阴性的患者,如PD-L1表达阳性(≥1%)可在铂类为基础的化疗后行阿替利珠辅助治疗(2A类推荐证据)。
(2)非完整切除切缘阳性NSCLC的后续治疗:①ⅠA(T1a/b/cN0)期患者,术中发现为R1或R2切除,均首选再次手术,放疗也可供选择(2B类推荐证据)。②ⅠB(T2aN0)/ⅡA(T2bN0)期患者,术中发现为R1或R2切除,均应首选再次手术,放疗也可供选择,后续化疗视情况而定。ⅠB期有高危险因素者[如低分化肿瘤(包括神经内分泌肿瘤但不包括分化良好的神经内分泌肿瘤)、脉管侵犯、楔形切除、脏层胸膜侵犯、未知的淋巴结状态Rx]可考虑进行术后辅助化疗,病理亚型以实体型或微乳头为主的ⅠB期腺癌患者也可考虑辅助化疗(2B类推荐证据)。ⅡA期患者均应进行辅助化疗(2A类推荐证据)。③ⅡB期R1切除患者可选择再次手术和术后辅助化疗,或同步或序贯放化疗;R2切除患者可选择再次手术和术后辅助化疗,或者同步放化疗(2A类推荐证据)。
6.同期多原发癌(2B类推荐证据,图6)
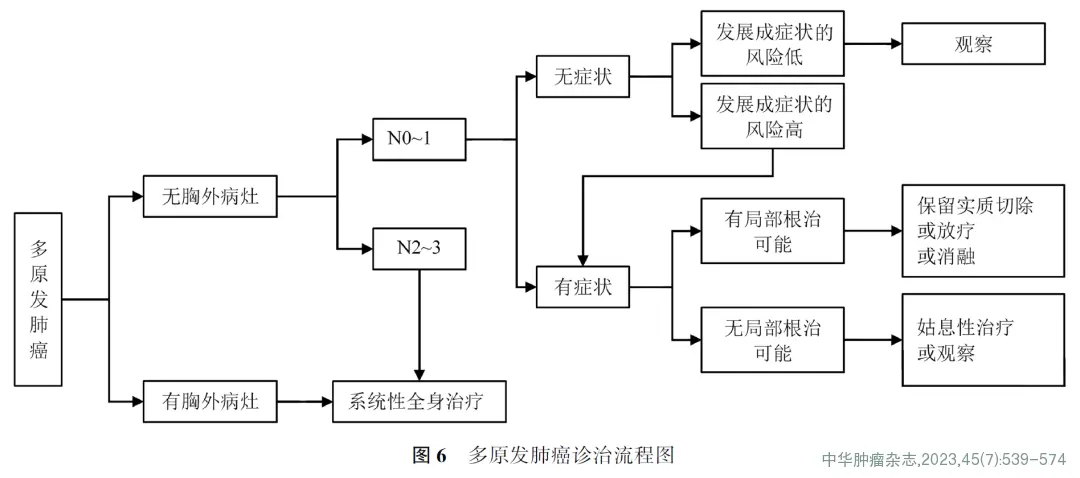
(1)诊断:多原发癌定义为①各癌灶组织学类型不同;②各癌灶具有不同的分子遗传特征;③各癌灶由不同原位癌起源;④各癌灶组织学类型相同时,各癌灶位于不同肺叶且无纵隔淋巴结转移及无全身转移。
(2)分期:针对每一个病灶进行TNM分期(2A类推荐证据)。
(3)治疗:首选外科手术治疗。①优先处理主病灶,兼顾次要病灶,在不影响患者生存及符合无瘤原则的前提下尽量切除病灶,并尽可能保留肺功能(如亚肺叶切除)(2A类推荐证据)。②次要病灶若为纯GGO,受限于心肺功能无法全部切除病灶时,建议6~12个月随访1次,若无变化,每2年随访1次(2A类推荐证据)。
7.不适合手术或拒绝手术的早期NSCLC推荐放射治疗
不适合手术或拒绝手术的早期NSCLC的放射治疗,首选SBRT(1类推荐证据),适应证包括:(1)不耐受手术的早期NSCLC:高龄、严重内科疾病、T1~2N0M0期。(2)可手术但拒绝手术的早期NSCLC。(3)不能施行或拒绝接受病理诊断的临床早期肺癌,在满足下列条件的情况下,可考虑进行SBRT治疗:①明确的影像学诊断,病灶在长期随访(>2年)过程中进行性增大,或磨玻璃影的密度增高、实性比例增大,或伴有血管穿行及边缘毛刺样改变等恶性特征;至少2种影像学检查(如胸部增强1~3 mm薄层CT和全身PET-CT)提示恶性;②经肺癌多学科协作组讨论确定;③患者及家属充分知情同意。(4)相对适应证:①T3N0M0;②同时性多原发NSCLC。
(二)Ⅲ期NSCLC患者的综合治疗
1.可切除类Ⅲ期NSCLC(图7、图8)

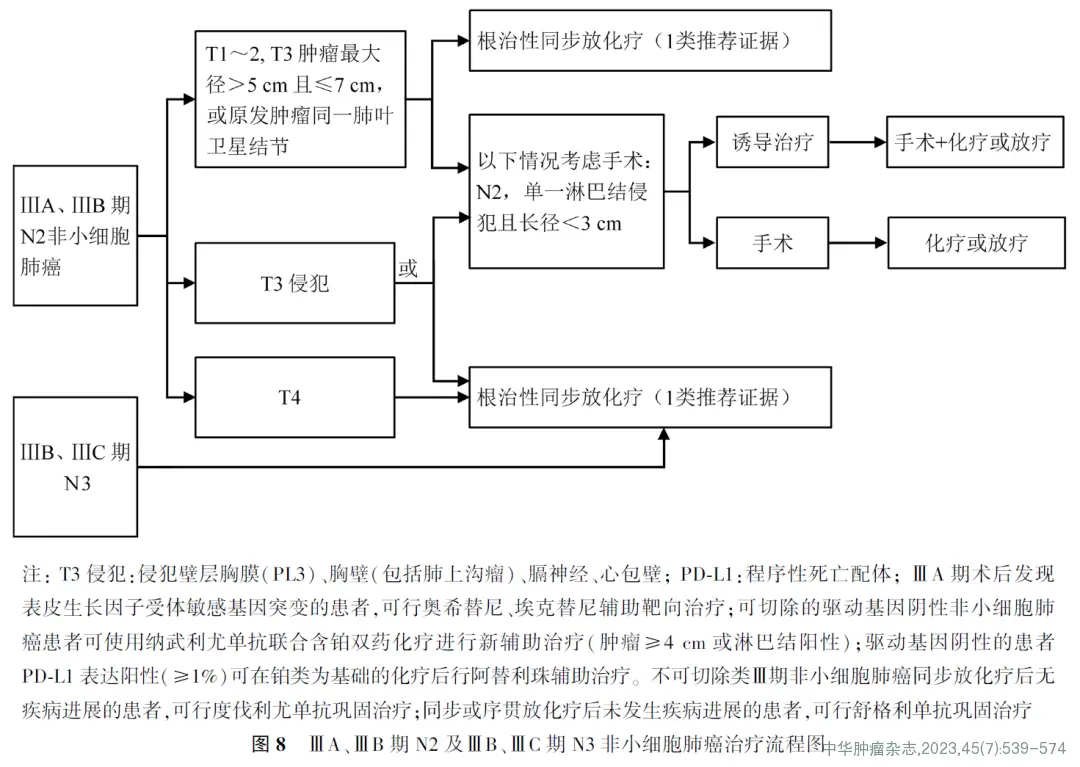
Ⅲ期NSCLC可切除类是指T3N1、T4N0~1和部分T1~2N2,少部分ⅢB期(指T3N2,N2为单一淋巴结转移且长径<3 cm)。外科的角色主要取决于肿瘤的可切除性。多学科综合治疗模式是以外科为主的综合治疗。是否可外科手术切除需要多学科团队综合评估。
(1)手术耐受性评估:术前必须评估患者的心肺功能,推荐使用心电图和肺功能检查进行评估(1类推荐证据)。由于ⅢA期患者术后需行辅助治疗,因此术前应考虑患者的残肺功能是否可以耐受化疗和放疗(2A类推荐证据)。术前须排除患者其他器官的严重合并症,包括6个月内心脑血管事件(心肌梗死、中风等)、心力衰竭、心律失常、肾衰竭等(2A类推荐证据)。高龄患者的数据报道较少,手术应谨慎(2A类推荐证据)。
(2)手术时机和方式:可能完全切除的驱动基因阴性肿瘤患者可使用化疗或纳武利尤单抗联合含铂双药化疗进行新辅助治疗(肿瘤≥4 cm或淋巴结阳性,1类推荐证据),建议接受术后辅助治疗(2B类推荐证据)。外科医师可在综合评估患者情况后决定手术时机(2B类推荐证据)。
推荐进行彻底的纵隔淋巴结清扫,即右侧清扫2R、4R、7、8、9组淋巴结,左侧清扫4L、5~9组淋巴结(1类推荐证据)。推荐整块切除淋巴结(2A类推荐证据)。
手术的原则为在完全切除肿瘤的基础上尽可能保留肺组织(1类推荐证据)。在术前充分评估的基础上,视肿瘤浸润范围可行肺叶、复合肺叶、袖状以及全肺切除,推荐患者至有条件的大型医院进行此类手术(2A类推荐证据)。
ⅢA期可手术的NSCLC完全切除术后推荐辅助含铂两药化疗(1类推荐证据)。不常规推荐术后辅助放疗,建议进行多学科会诊,评估术后辅助放疗对于N2期患者的治疗获益与风险(2B类推荐证据)。对于术后发现EGFR敏感基因突变的患者,可行埃克替尼、奥希替尼辅助靶向治疗(1类推荐证据)。术后驱动基因阴性的患者,如PD-L1表达阳性(≥1%)可在铂类为基础的化疗后行阿替利珠辅助治疗(2A类推荐证据)。
2.不可切除类Ⅲ期NSCLC
Ⅲ期不可切除的NSCLC包括以下几类:同侧多枚成团或多站纵隔淋巴结转移[ⅢA(T1~3N2)或ⅢB(T3~4N2)];对侧肺门、纵隔淋巴结,或同侧、对侧斜角肌或锁骨上淋巴结转移[ⅢB、ⅢC(T1~4N3)];不可或不适合切除肿瘤包括部分肺上沟瘤[主要指肿瘤侵犯椎体超过50%,臂丛神经受侵犯,食管、心脏或气管受侵犯等,ⅢA(T3N1、T4N0~1)]。
局部晚期无法手术患者治疗方法选择,除了需要考虑到肿瘤因素外,还需要结合患者一般情况和治疗前有无明显体质下降,以及正常组织器官(如肺、脊髓、心脏、食管和臂丛神经等)对放疗的耐受剂量等进行综合考虑,根据实际情况选择放化疗剂量。
(1)推荐根治性同步放化疗(1类推荐证据):①同步放疗:原发灶+转移淋巴结累及野放疗,累及野放疗可以更优化肿瘤组织剂量和正常组织的毒性剂量;PET-CT图像能明显提高靶区勾画的准确性,特别是存在明显肺不张或静脉增强禁忌证的患者。推荐根治性处方剂量为60~70 Gy,2 Gy/次,最小处方剂量至少60 Gy,但最佳放疗剂量仍不确定,>70 Gy不推荐作为常规用量。临床常规采用三维适形放疗、调强放疗(intensity modulated radiotherapy, IMRT),但IMRT为更好的选择,其能降低高级别放射性肺炎的发生,可减少不良反应。②以铂类为主的同步化疗方案(1类推荐证据):(a)依托泊苷+顺铂;(b)长春瑞滨+顺铂;(c)培美曲塞+顺铂或卡铂(非鳞状细胞癌);(d)紫杉醇类+顺铂或卡铂。建议同步放化疗期间至少完成2个周期的常规化疗方案,也可采用每周低剂量化疗方案。
(2)序贯放化疗:若患者无法耐受同步化放疗,序贯放化疗优于单纯放疗(2A类推荐证据)。放疗方案同前,增加放疗剂量有可能改善患者生存(2B类推荐证据)。序贯化疗方案如下(1类推荐证据):①长春瑞滨+顺铂;②紫杉醇+顺铂或卡铂;③培美曲塞+顺铂或卡铂(非鳞状细胞癌)。建议行2~4个周期评估后再行放疗。
(3)诱导和巩固治疗:①若无法耐受放化疗综合性治疗[患者一般情况差,伴内科合并症,体质明显下降和(或)患者意愿],单纯放疗是标准治疗(2A类推荐证据)。放疗方案同根治性同步放化疗中的放疗方案,增加放疗剂量有可能改善生存(2B类推荐证据),最佳放疗剂量不确定。②尽管对于大负荷肿瘤,临床上通过诱导化疗来降低肿瘤体积,获得化放疗同步治疗机会,但无证据显示诱导化疗能提高生存获益(2A类推荐证据)。③同步化放疗后推荐免疫检查点抑制剂如度伐利尤单抗进行巩固治疗(1类推荐证据);同步或序贯放化疗后推荐舒格利单抗进行巩固治疗(1类推荐证据);若不使用免疫检查点抑制剂进行巩固治疗,对于潜在转移风险大或同步期间化疗未达到足量的患者,可考虑应用巩固化疗(2A类推荐证据)。
(三)Ⅳ期NSCLC患者的全身治疗(图9)

1.一线治疗
(1)非鳞状细胞癌驱动基因阳性且不伴有耐药基因突变患者的治疗
① EGFR敏感基因突变的患者:推荐使用EGFR-TKI,可选择奥希替尼、阿美替尼、伏美替尼、吉非替尼、厄洛替尼、埃克替尼、阿法替尼(1类推荐证据)或达可替尼(2A类推荐证据);也可使用厄洛替尼联合贝伐珠单抗(2A类推荐证据),化疗联合吉非替尼(PS评分为2分以下);对于G719X、L861Q、S768I等非经典基因突变的患者,首先推荐阿法替尼。一线已经开始化疗的过程中发现EGFR敏感基因突变的患者,推荐完成常规化疗(包括维持治疗)后换用EGFR-TKI,或者中断化疗后开始靶向治疗(2A类推荐证据)。
② ALK融合基因阳性的患者:可选择洛拉替尼、恩沙替尼、阿来替尼、塞瑞替尼、布格替尼、克唑替尼(1类推荐证据)。一线已经开始化疗的过程中发现ALK融合基因阳性的患者,推荐可完成常规化疗,包括维持治疗后换用靶向治疗或者中断化疗后开始靶向治疗(2A类推荐证据)。
③ ROS1融合基因阳性的患者:推荐选择克唑替尼(1类推荐证据)或恩曲替尼(1类推荐证据),也可接受含铂双药化疗或者含铂双药化疗+贝伐珠单抗(2A类证据)。
④ MET14外显子跳突的局部晚期或转移性NSCLC患者:可使用谷美替尼(2A类推荐证据),无法耐受化疗或含铂化疗后疾病进展可使用赛沃替尼(2A类推荐证据)。
⑤ BRAF V600突变阳性的晚期NSCLC患者:可使用达拉非尼联合曲美替尼(2A类推荐证据)。
⑥ RET融合基因阳性的局部晚期或转移性NSCLC患者:可使用塞普替尼(2A类推荐证据)。
其他少见突变者可接受含铂双药化疗或参加临床试验。
(2)非鳞状细胞癌驱动基因阴性患者的治疗
对于PD-L1表达阳性(≥1%)的患者可单药使用帕博利珠单抗,但PD-L1高表达(≥50%)的患者获益更明显(1类推荐证据)。对于PD-L1高表达(≥50%)的患者,也可单药使用阿替利珠单抗(2A类推荐证据)。
① PS评分0~1分的患者:推荐培美曲塞+铂类+帕博利珠单抗化疗(1类推荐证据),或培美曲塞+铂类+阿替利珠单抗(2A类推荐证据),或培美曲塞+卡铂+卡瑞利珠单抗(2A类推荐证据),或培美曲塞+铂类+信迪利单抗(2A类推荐证据),或培美曲塞+铂类+替雷利珠单抗(2A类推荐证据),或培美曲塞+卡铂+舒格利单抗(2A类推荐证据),或培美曲塞+铂类+特瑞普利单抗(2A类推荐证据);也可使用含铂两药联合的方案化疗,化疗4~6个周期,铂类可选择卡铂或顺铂、洛铂,与铂类联合使用的药物包括培美曲塞、紫杉醇、紫杉醇脂质体、紫杉醇聚合物胶束、吉西他滨或多西他赛(1类推荐证据);培美曲塞联合顺铂可以明显延长患者生存时间,且在疗效和降低不良反应方面优于吉西他滨联合顺铂(2A类推荐证据);对不适合铂类药物治疗的患者,可考虑非铂类两药联合方案化疗,包括吉西他滨联合长春瑞滨或吉西他滨联合多西他赛(1类推荐证据)。对于无禁忌证患者可选择贝伐珠单抗或重组人血管内皮抑制素,与化疗联用并进行维持治疗(1类或2A类推荐证据),紫杉醇及卡铂为推荐方案(1类推荐证据),禁忌证包括中央型肺癌、近期有活动性出血、血小板降低、难以控制的高血压、肾病综合征、血栓相关事件、充血性心力衰竭、抗凝治疗等。
② PS评分2分的患者:推荐单药治疗。与最佳支持治疗相比,单药化疗可以延长患者生存时间并提高生命质量。可选的单药包括吉西他滨、长春瑞滨、紫杉醇、多西他赛、培美曲塞(2A类推荐证据)。
③ PS评分3~4分的患者:不建议使用细胞毒类药物化疗。此类患者一般不能从化疗中获益,建议采用最佳支持治疗或参加临床试验。
④一线化疗4~6个周期达到疾病控制(完全缓解、部分缓解和稳定)且PS评分好、化疗耐受性好的患者:可选择维持治疗。同药维持治疗的药物为帕博利珠单抗+培美曲塞、阿替利珠单抗+培美曲塞、卡瑞利珠单抗+培美曲塞、信迪利单抗+培美曲塞、替雷利珠单抗+培美曲塞、舒格利单抗+培美曲塞、特瑞普利单抗+培美曲塞、培美曲塞、吉西他滨或贝伐珠单抗(1类推荐证据);换药维持治疗的药物为培美曲塞(1类推荐证据)。
(3)鳞状细胞癌驱动基因阴性患者的治疗
对于PD-L1表达阳性(≥1%)的患者可单药使用帕博利珠单抗,但PD-L1高表达(≥50%)的患者获益更明显(1类推荐证据)。对于PD-L1高表达(≥50%)的患者,也可单药使用阿替利珠单抗(2A类推荐证据)。
① PS评分0~1分的患者:推荐紫杉醇+卡铂+帕博利珠单抗化疗(1类推荐证据),或紫杉醇+卡铂+替雷利珠单抗(2A类推荐证据),或紫杉醇+卡铂+卡瑞利珠单抗(2A类推荐证据),或吉西他滨+铂类+信迪利单抗(2A类推荐证据),或紫杉醇+卡铂+舒格利单抗(2A类推荐证据),或白蛋白紫杉醇+卡铂+斯鲁利单抗(2A类推荐证据),或紫杉醇+卡铂+派安普利单抗(2A类推荐证据)。也可使用含铂两药联合的方案化疗,化疗4~6个周期,铂类可选择卡铂、顺铂、洛铂或奈达铂,与铂类联合使用的药物包括紫杉醇、紫杉醇脂质体、紫杉醇聚合物胶束、吉西他滨或多西他赛(1类推荐证据)或白蛋白紫杉醇;对不适合铂类药物治疗的患者,可考虑非铂类两药联合方案化疗,包括吉西他滨联合长春瑞滨或吉西他滨联合多西他赛。
② PS评分2分的患者:推荐单药化疗。与最佳支持治疗相比,单药化疗可以延长生存时间并提高生活质量,可选的单药包括吉西他滨、长春瑞滨、紫杉醇、多西他赛(2A类推荐证据)。
③ PS评分3~4分的患者:建议采用最佳支持治疗或参加临床试验。
④一线化疗4~6个周期达到疾病控制(完全缓解、部分缓解和稳定)且PS评分好、化疗耐受性好的患者:可选择维持治疗。同药维持治疗的药物为帕博利珠单抗、替雷利珠单抗、卡瑞利珠单抗、信迪利单抗、舒格利单抗、斯鲁利单抗、派安普利单抗、吉西他滨(1类推荐证据),也可选择多西他赛(2A类推荐证据)。
(4)鳞状细胞癌驱动基因阳性患者的治疗
尽管晚期NSCLC中的腺癌EGFR突变率明显高于非腺癌,但在非腺癌中检测的EGFR突变结果支持对所有NSCLC患者进行EGFR检测。推荐对不吸烟、小标本或混合型的鳞状细胞癌患者进行EGFR、ALK、ROS1、BRAFV600和MET14外显子跳跃检测(2A类推荐证据)。
鳞癌驱动基因阳性患者的治疗参照非鳞状细胞癌驱动基因阳性患者治疗方法。
2.二线及后线治疗
首先积极鼓励后线患者参加新药临床试验。
(1)非鳞状细胞癌驱动基因阳性患者的治疗
① EGFR驱动基因阳性的Ⅳ期非鳞状细胞癌患者:如果一线未使用EGFR-TKI,二线治疗时建议首先使用EGFR-TKI(1类推荐证据)。EGFR 20号外显子插入突变的患者含铂化疗期间或之后进展可使用莫博赛替尼(2A类推荐证据)。一线使用EGFR-TKI后疾病进展患者,根据进展类型分为寡进展型、广泛进展型。(a)若为寡进展型,推荐继续原EGFR-TKI治疗±局部治疗(2A类推荐证据)。治疗后再次进展,推荐二次活组织检查检测T790M突变状态。(b)若为广泛进展型,一代/二代TKI耐药后推荐二次活组织检查检测T790M突变状态,T790M阳性者,推荐奥希替尼或阿美替尼、伏美替尼治疗(1类推荐证据),T790M阴性者推荐含铂双药化疗联合或不联合贝伐珠单抗(非鳞癌患者)(1类推荐证据)。若未进行T790M状态检测,推荐含铂双药化疗联合或不联合贝伐珠单抗(非鳞癌患者)。三线PS评分0~2分可接受单药化疗或在无禁忌证的情况下推荐使用安罗替尼(2A类推荐证据)。
② ALK融合基因阳性的Ⅳ期非鳞状细胞癌患者:如果一线未使用ALK-TKI,二线治疗时建议首先使用ALK-TKI,也可使用含铂双药化疗(1类推荐证据)。一线克唑替尼治疗出现疾病进展者,若为寡进展推荐继续口服克唑替尼±局部治疗(2A类推荐证据);若为快速进展者,推荐洛拉替尼、阿来替尼或塞瑞替尼或恩沙替尼(1类推荐证据)或布格替尼(2A类推荐证据)治疗,也可接受含铂双药化疗(2A类推荐证据)。在无禁忌证的情况下,三线可使用安罗替尼(2A类推荐证据)。
③ ROS1基因重排阳性的Ⅳ期非鳞状细胞癌患者:若一线接受克唑替尼治疗后进展者,建议接受恩曲替尼(2A类推荐证据)或含铂双药化疗(2A类推荐证据)。在无禁忌证的情况下,三线推荐使用安罗替尼(2A类推荐证据)。
④ RET融合基因阳性的Ⅳ期非鳞状细胞癌患者:铂类化疗进展后可使用普拉替尼、赛普替尼(2A类推荐证据)。
⑤ NTRK融合的局部晚期或转移性非鳞状细胞癌初始治疗进展后可使用恩曲替尼(2A类推荐证据)、拉罗替尼(2A类推荐证据)。
(2)非鳞状细胞癌驱动基因阴性患者的治疗
PS评分0~2分驱动基因阴性非鳞状细胞癌患者一线进展后,如未接受过免疫治疗,推荐二线治疗使用纳武利尤单抗(1类推荐证据)、或替雷利珠单抗(2A类推荐证据)。PS评分0~2分驱动基因阴性非鳞状细胞癌患者一线进展后也可使用多西他赛(1类推荐证据)或培美曲塞(2A类推荐证据)单药化疗。对于PS评分>2分的患者,二线建议最佳支持治疗。若前期未使用培美曲塞或多西他赛单药治疗者,三线可接受培美曲塞或多西他赛单药治疗(2A类推荐证据),或在无禁忌证的情况下推荐使用安罗替尼(2A类推荐证据),后线建议最佳支持治疗。
(3)鳞状细胞癌驱动基因阳性患者的治疗
对于EGFR敏感基因突变的Ⅳ期鳞状细胞癌患者,如果一线未使用EGFR-TKI,二线治疗时建议首先使用EGFR-TKI(2B类推荐证据)。若一线使用EGFR-TKI后疾病进展,参照非鳞状细胞癌驱动基因阳性患者的治疗。三线建议单药化疗,或在无禁忌证的情况下推荐使用安罗替尼(2A类推荐证据)。
(4)鳞状细胞癌驱动基因阴性患者的治疗
PS评分0~2分驱动基因阴性鳞状细胞癌患者一线进展后,如果未接受过免疫治疗,推荐二线治疗使用纳武利尤单抗(1类推荐证据)、或替雷利珠单抗(2A类推荐证据)。PS评分0~2分驱动基因阴性的鳞状细胞癌患者一线进展后也可使用多西他赛单药化疗(1类推荐证据)。对于PS评分>2分的患者,二线及后线建议最佳支持治疗。三线在无禁忌证的情况下推荐使用安罗替尼(2A类推荐证据)。
对于接受可能引起中、高度中性粒细胞减少伴发热风险的化疗方案的患者,可考虑预防性使用重组人粒细胞集落刺激因子或聚乙二醇化重组人粒细胞集落刺激因子。
(四)寡病灶转移的Ⅳ期NSCLC患者的治疗
寡转移分为同时性寡转移和异时性寡转移。同时性寡转移是指初次确诊时已经出现的寡转移灶,异时性寡转移是指经过治疗后一段时间出现的寡转移灶。
NSCLC寡转移患者经有效的全身治疗后,采用放疗、手术等局部治疗手段可以带来临床获益,多学科综合治疗策略可以使肺癌寡转移患者获益最大化。肺部手术前存在孤立性脏器(脑、肾上腺或骨)转移者,应根据肺部病变分期原则进行手术或放疗和术后治疗。孤立性脏器转移灶的治疗按照部位进行:(1)脑或肾上腺转移者积极行局部治疗,包括手术切除脑或肾上腺转移瘤,或者脑或肾上腺转移瘤行常规放疗/SBRT(2A类推荐证据)。若患者已合并明显的中枢神经系统症状,影像学检查提示有脑转移瘤压迫水肿显著或中线结构偏移严重等情况,建议先行脑转移瘤手术解除颅脑问题,择期再行肺原发瘤手术(2A类推荐证据)。(2)骨转移者接受放疗联合双膦酸盐治疗。对于承重骨转移推荐转移灶手术加放疗(2A类推荐证据)。
肺部手术后出现孤立性脏器(脑、肾上腺或骨)转移的,应根据孤立性脏器转移灶部位进行治疗。(1)脑转移或肾上腺转移者积极行局部治疗,包括手术切除脑或肾上腺转移瘤,或脑或肾上腺转移瘤行常规放疗/SBRT,根据情况联合全身治疗(2A类推荐证据)。(2)骨转移者接受放疗联合双膦酸盐治疗。对于承重骨转移患者推荐转移灶手术加放疗,根据情况联合全身治疗(2A类推荐证据)。
总之,对于寡转移晚期NSCLC患者,在全身规范治疗基础上,应采取积极的局部治疗,使患者生存获益达到最大化。
(五)SCLC和LCNEC的治疗
1.SCLC的治疗
(1)局限期SCLC患者的治疗(图10)

①可手术局限期SCLC患者(T1~2N0)的治疗:经系统的分期检查后提示无淋巴结转移的T1~2N0的患者,推荐根治性手术,术式为肺叶切除术+肺门、纵隔淋巴结清扫术(2A类推荐证据);术后病理提示N0的患者推荐辅助化疗,方案包括依托泊苷+顺铂、依托泊苷+卡铂(2A类推荐证据);术后病理提示N1和N2的患者,推荐行辅助化疗合并胸部放疗(2A类推荐证据),同步或序贯均可。辅助化疗方案推荐依托泊苷+顺铂(1类推荐证据)。可以根据患者的实际情况决定是否行预防性脑放疗(prophylactic cranial irradiation, PCI;1类推荐证据)。
②不可手术局限期SCLC患者(超过T1~2N0或不能手术的T1~2N0)的治疗:(a)PS评分0~2分的患者:化疗同步胸部放疗为标准治疗(1类推荐证据)。化疗方案为依托泊苷+顺铂(1类推荐证据)和依托泊苷+卡铂(1类推荐证据)。胸部放疗应在化疗的第1~2个周期尽早介入。如果患者不能耐受,也可行序贯化放疗。放疗最佳剂量和方案尚未确定,推荐胸部放疗总剂量为45 Gy,1.5 Gy/次,2次/d,3周,或总剂量为60~70 Gy,1.8~2.0 Gy/次,1次/d,6~8周。对于特殊的临床情况,如巨大肿瘤、合并肺功能损害、阻塞性肺不张等,可考虑2个周期化疗后进行放疗。放化疗后疗效达完全缓解或部分缓解的患者,可考虑行PCI(2A类推荐证据)。(b)PS评分3~4分(由SCLC所致)患者:建议应充分综合考虑各种因素,谨慎选择治疗方案,如化疗(单药方案或减量联合方案),如果治疗后PS评分能达到2分以下,可考虑给予同步或序贯放疗,如果PS评分仍无法恢复至2分以下,则根据具体情况决定是否采用胸部放疗。放化疗后疗效达完全缓解或部分缓解的患者,可考虑行PCI(2A类推荐证据)。(c)ECOG PS评分3~4分(非SCLC所致)患者:推荐最佳支持治疗。
(2)广泛期SCLC患者的一线治疗(图11)
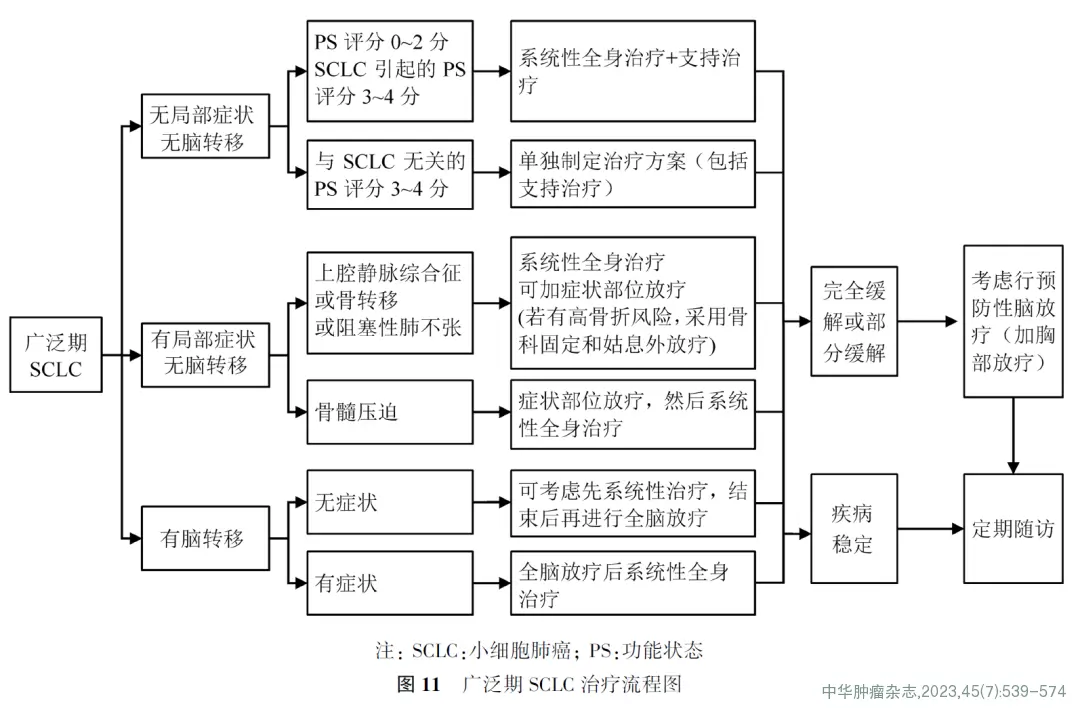
①无症状或无脑转移的广泛期SCLC患者的治疗:
(a)PS评分0~2分患者:推荐依托泊苷+卡铂+阿替利珠单抗、依托泊苷+铂类+度伐利尤单抗(1类推荐证据),或依托泊苷+铂类+阿得贝利单抗(1类推荐证据),或依托泊苷+铂类+斯鲁利单抗(1类推荐证据),或依托泊苷+铂类化疗。
(b)PS评分3~4分(由SCLC所致):推荐化疗,方案包括EP方案(依托泊苷+顺铂)(1类推荐证据)、EC方案(依托泊苷+卡铂)(1类推荐证据)、IP方案(伊立替康+顺铂)(1类推荐证据)、IC方案(伊立替康+卡铂)(1类推荐证据)、依托泊苷+洛铂(2A类推荐证据)。曲拉西利可在EP/EC方案治疗前预防性给药,以降低化疗引起的骨髓抑制的发生率(1类推荐证据)。化疗后疗效达完全缓解或部分缓解的患者,如果远处转移灶得到控制,且一般状态较好,可以加用胸部放疗(2A类推荐证据);酌情谨慎选择PCI(2A类推荐证据)。
(c)ECOG PS评分3~4分(非SCLC所致)患者:推荐最佳支持治疗。
②局部症状的广泛期SCLC患者的治疗:
(a)上腔静脉综合征:临床症状严重者推荐先放疗后化疗(2A类推荐证据);临床症状较轻者推荐先化疗后放疗(2A类推荐证据),同时给予吸氧、利尿、镇静、止痛等对症治疗。局部放疗的放射野应包括原发灶、整个纵隔区及两锁骨上区,要将上腔静脉包括在照射野内;放疗初期可能出现局部水肿加重,必要时可使用激素和利尿剂辅助治疗;首次化疗应具有冲击性。放化疗结束后,根据患者具体情况决定是否行PCI(2A类推荐证据)。
(b)脊髓压迫症:如无特殊情况,患者应首先接受局部放疗,控制压迫症状,并给予化疗(2A类推荐证据)。由于脊髓压迫症的患者生存时间较短,生命质量较差,所以对于胸部放疗和PCI的选择需综合考量多方因素,慎重选择(如完全缓解或部分缓解的患者可以放疗),但通常不建议手术减压治疗。
(c)骨转移:推荐化疗+局部姑息外照射放疗±双膦酸盐治疗(2A类推荐证据);骨折高危患者可采取骨科固定。
(d)阻塞性肺不张:推荐化疗+胸部放疗(2A类推荐证据)。2个周期化疗后进行放疗易于明确病变范围,缩小照射体积,使患者能够耐受和完成放疗。
③脑转移患者的治疗:
(a)无症状脑转移患者:全身化疗结束后接受全脑放疗(2A类推荐证据),若为脑寡转移,也可以考虑立体定向放射外科治疗(2B类推荐证据)。
(b)有症状脑转移患者:推荐全脑放疗与化疗序贯进行(2A类推荐证据),治疗后疗效达完全缓解或部分缓解的患者,若为脑寡转移,也可以考虑立体定向放射外科治疗(2B类推荐证据)。
(3)SCLC患者的PCI
制定PCI的治疗决策时应与患者和家属充分沟通,根据患者的具体情况,权衡利弊后确定。对于完全切除的局限期SCLC,根据实际情况决定是否接受PCI治疗(2A类推荐证据);对于获得完全缓解、部分缓解的局限期SCLC,推荐PCI(2A类推荐证据);对于广泛期SCLC,酌情考虑PCI(2A类推荐证据)。不推荐年龄>65岁、有严重的合并症、PS评分>2分、神经认知功能受损的患者行PCI。PCI应在化放疗结束后3周左右时开始,PCI之前应行脑增强MRI检查,如证实无脑转移,可开始PCI,有技术条件的医疗中心也可考虑基于海马保护的PCI。PCI的剂量为25 Gy,2.5 Gy/次。
(4)二线治疗(图12)
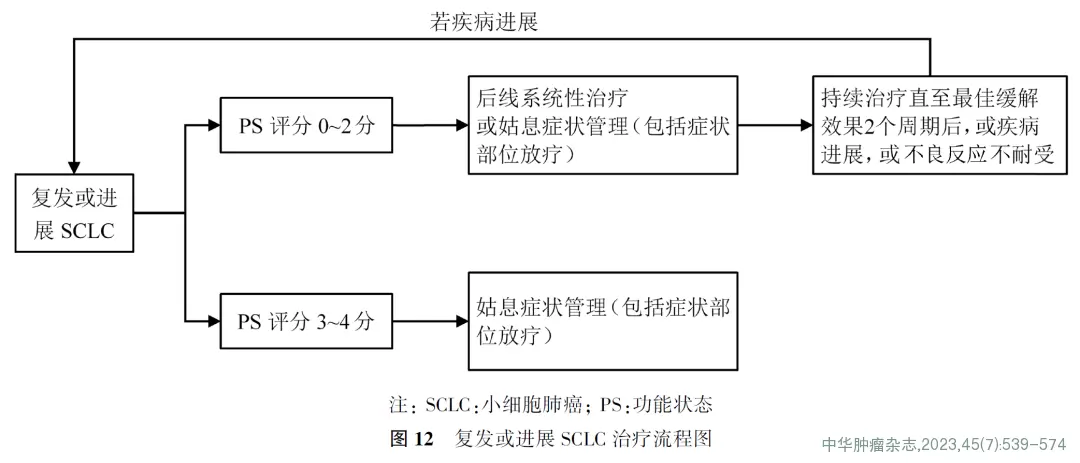
①一线治疗后6个月内复发的PS评分0~2分患者:推荐选择静脉或口服拓扑替康化疗(2A类推荐证据),也可推荐患者参加临床试验或选用以下药物,包括伊立替康(2A类推荐证据)、紫杉醇(2A类推荐证据)、多西他赛(2A类推荐证据)、长春瑞滨(2A类推荐证据)、吉西他滨(2A类推荐证据)、替莫唑胺(2A类推荐证据)、环磷酰胺联合多柔比星及长春新碱(2A类推荐证据)。PS评分2分的患者可酌情减量或应用集落刺激因子支持治疗。
②一线治疗后6个月以上复发患者:选用原一线治疗方案。
(5)三线治疗
推荐安罗替尼口服(1类推荐证据)。
(6)老年SCLC患者的治疗
对于老年SCLC患者,不能仅根据年龄确定治疗方案,根据机体功能状态指导治疗更有意义。如果老年患者有日常生活自理能力、体力状况良好、器官功能相对较好,应当接受标准联合化疗(如有指征也可放疗),但因老年患者可能出现骨髓抑制、乏力和器官功能受损的概率更高,所以在治疗过程中应严密观察。
2.肺LCNEC患者的治疗
肺LCNEC的发病率低,占肺癌的3%,目前尚无统一的治疗标准,内科治疗可采用依托泊苷+铂类方案治疗(2B类推荐证据)。
六随访(一)Ⅰ~Ⅱ期(初始治疗为外科手术±化疗或SBRT治疗后)和可手术切除ⅢA和ⅢB期NSCLC R0切除术后,无临床症状或症状稳定者
1.前3年
3~6个月随访1次,吸烟情况评估(鼓励患者戒烟),病史、体格检查、胸部CT±增强扫描。
2.第4、5年
1年随访1次,吸烟情况评估(鼓励患者戒烟),病史、体格检查、胸部CT±增强扫描。
3.5年以上
1年随访1次,吸烟情况评估(鼓励患者戒烟),病史、体格检查,低剂量非增强胸部CT(2B类推荐证据)。
(二)局部晚期NSCLC(不可手术的ⅢA期和ⅢB期)放化疗后,无临床症状或症状稳定者
1.无临床症状或症状稳定者
每8~12周随诊1次;病史、体格检查、胸腹部增强CT;参加临床试验者,随访应遵循临床研究方案进行。
2.临床出现新的症状和(或)症状加重者
立即随诊,是否行CT、MRI等检查由临床医师决定(2B类推荐证据)。
(三)Ⅳ期NSCLC患者全身治疗结束后
1.无临床症状或症状稳定者
每8~12周随诊1次;病史、体格检查、胸腹部增强CT;伴有脑、骨转移者需要复查脑MRI和全身骨扫描;参加临床试验者,随访应遵循临床研究方案进行。
2.临床出现新的症状和(或)症状加重者
立即随诊,是否行CT、MRI检查由临床医师决定(2B类推荐证据)。
本指南强调了肺癌筛查、诊断、病理、治疗和随访等诊治措施在国内应用的规范性及可及性,以国家批准的应用指征为原则及准绳,以国内实际可应用的药品为基础,结合国际会议上发表的中国专家基于中国患者的最新肺癌诊疗相关基础研究报告以及中国肺癌领域专家在过去1年中取得的学术进展,在2022版本基础上进行更新,最终形成2023版肺癌临床诊疗指南。参考文献略。