肾细胞癌(RCC)是常见的泌尿系统恶性肿瘤,其中透明细胞肾癌(ccRCC)和非透明细胞肾癌(nccRCC)是主要亚型。尤其值得关注的是乳头状肾细胞癌(pRCC),作为nccRCC中最常见的类型,其发病率相对较低,但临床表现复杂,异质性强,且中晚期患者预后不佳,早期精准诊断面临挑战,常有误诊情况发生。传统的影像学检查和侵入性组织活检存在局限性,促使医学界积极探索更安全、高效的非侵入性诊断方法。
在这一背景下,血浆蛋白质组学与机器学习技术的结合,为肾细胞癌的精准诊断和预后预测带来了革命性的突破。一项由复旦大学团队牵头,并发表在《Journal of Hematology & Oncology》杂志上的最新临床研究,正是这一前沿探索的典范,为乳头状肾细胞癌等患者的早期筛查和个体化治疗策略制定开辟了新途径。
突破性研究:血浆蛋白质组学赋能肾细胞癌精准诊断
这项开创性研究聚焦于发病率较低但异质性强的乳头状肾细胞癌(pRCC),创新性地利用非侵入性血浆样本,结合先进的质谱蛋白质组学技术,构建了一系列基于蛋白质组的机器学习预测模型。研究团队共采集了涵盖713例患者的三组独立队列样本,旨在系统性地建立并验证这些模型,以实现肾细胞癌亚型的准确诊断、TNM分期评估以及无进展生存的动态风险预测。

核心发现:多维度模型提升诊断与预后精度
研究设计与样本概况
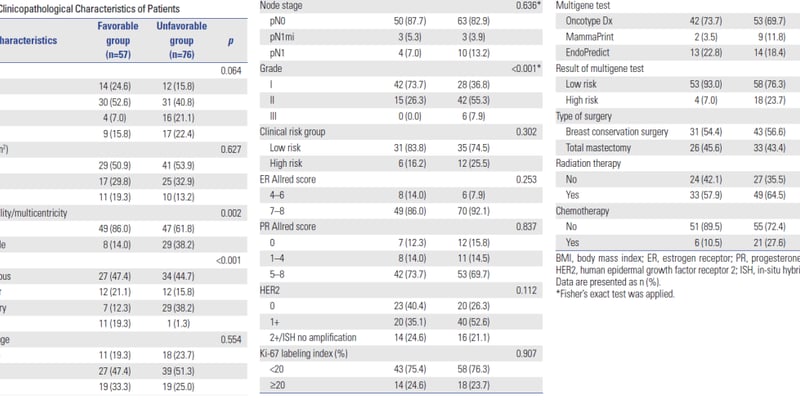
研究共纳入三大队列:479例发现队列、140例时间独立验证队列和94例外部独立验证队列。这些队列涵盖了乳头状肾细胞癌(pRCC)、透明细胞肾癌(ccRCC)、嗜酸细胞肾癌(chRCC)患者以及健康对照人群,确保了研究结果的广泛适用性和可靠性。此外,研究还对15例pRCC患者的配对肿瘤及邻近正常组织进行了蛋白组分析,以验证组织与血浆蛋白表达的一致性。
| 队列类型 | pRCC患者 | ccRCC患者 | chRCC患者 | 健康对照 |
|---|---|---|---|---|
| 发现队列 | 164 | 77 | 76 | 162 |
| 独立时间验证队列 | 48 | 23 | 22 | 47 |
| 外部验证队列 | 21 | 32 | 17 | 24 |
肾细胞癌亚型诊断模型的开发与验证
研究团队通过机器学习流程,筛选出16种低共线性蛋白质作为关键特征,并采用多种分类算法训练模型。这些模型在发现队列中表现卓越,主要指标如AUROC、平衡准确率、召回率、精确率及F1值均显示出极高的稳定性和优良性。即使对样本比例进行校正,模型表现依然稳健,宏平衡、微平均和加权平均AUROC均超过0.95。在独立时间与外部验证队列中,模型同样表现出色,AUROC均超过0.9,平均精确度(AP)分别约为0.91和0.88,充分证明了其优异的泛化能力,能够精准区分不同肾细胞癌亚型。

图:研究设计流程(A)、模型性能多指标评估(B)、两个独立验证队列上的表现(C、D)及16个蛋白标志物的重要性排名(E)
组织与血浆蛋白表达一致性验证
通过对乳头状肾细胞癌(pRCC)肿瘤及邻近正常组织的蛋白组分析,研究证实了多数重要蛋白在组织与血浆中的表达趋势高度一致,这进一步增强了血浆蛋白质组作为非侵入性诊断材料的可靠性。
TNM分期诊断模型:非侵入性评估癌症进展
鉴于TNM分期在肾细胞癌临床治疗决策中的核心地位,研究团队利用血浆蛋白组数据成功构建了TNM分期诊断模型。该模型在发现及验证队列中均表现出AUROC >0.90的优异性能,为现有侵入性活检或昂贵影像学分期提供了有力的非侵入式补充手段,有望减轻患者负担。
pRCC无进展生存(PFS)时间点“时间钟”预测模型:动态监测预后
针对乳头状肾细胞癌(pRCC)高恶性及较差预后的特点,研究团队开发了一款基于临床血常规指标及蛋白质组特征的“时间钟”模型,能够分时点(2、3、4、5年)预测患者的无进展生存状态。在发现队列中,所有时间点预测的AUROC及AP均超过0.89,且经bootstrap检验稳健性强。在独立时间验证队列中,模型表现进一步提升,各时间点AUROC和AP皆超过0.9,显示出精准分类能力。特征分析也揭示了预测中的关键蛋白及临床指标,印证了模型的生物学合理性。

图:复旦团队构建的肾细胞癌亚型区分模型
研究意义与未来展望
这项研究首次将大规模血浆蛋白质组数据与临床指标、机器学习技术深度融合,系统构建了一套多层次的肾细胞癌临床辅助模型,包括亚型诊断、TNM分期判断及PFS风险动态预测。这些模型性能卓越、稳定性好,并在多个独立队列中得到验证,展现出巨大的临床转化潜力。
其意义在于:精准区分不同肾细胞癌亚型,有助于避免误诊误治,指导个体化治疗;TNM分期模型辅助非侵入性快速评估癌症进展阶段,有望减少患者侵入性活检和昂贵影像检查的需求;而“时间钟”模型则为乳头状肾细胞癌患者的无进展生存预测提供了实时动态监测工具,有望提升临床随访效率和治疗方案调整的科学性。
本研究充分利用血浆这一易获取且安全的生物样本,实现了蛋白质组精准检测,填补了乳头状肾细胞癌生物标志物缺乏的空白。它为未来肾细胞癌的早期筛查、风险分层及疗效跟踪开辟了新路径,同时也为肿瘤蛋白质组学与机器学习在复杂异质性肿瘤精准医疗中的深度融合树立了典范。