癌症治疗的未来方向之一在于如何有效激活并维持患者自身的抗肿瘤免疫反应。传统的免疫疗法已取得显著进展,但要实现持久的临床效果,往往需要多维度、协同的免疫激活策略。在众多免疫调控通路中,OX40/OX40L共刺激通路因其在促进T细胞增殖、生存和记忆形成中的关键作用而备受关注。
与此同时,细菌凭借其天然的肿瘤靶向能力和免疫原性,正被改造为潜在的药物递送载体和治疗平台。结合合成生物学技术,通过基因工程让细菌表达治疗性分子,进一步拓展了其在肿瘤治疗领域的应用前景。此外,声动力疗法(SDT)作为一种非侵入性手段,利用超声激活声敏剂产生细胞毒性活性氧(ROS),不仅能直接杀伤肿瘤细胞,还能诱导免疫原性细胞死亡(ICD),释放肿瘤相关抗原,从而增强抗原呈递细胞(如树突状细胞)的功能,间接激活T细胞介导的抗肿瘤免疫。
将这些不同的治疗理念巧妙结合,有望产生更强大的抗癌协同效应。近期,一项发表在《Journal of the American Chemical Society》上的研究,由南开大学与中国医学科学院生物医学工程研究所的团队合作完成,便探索了这一创新路径。
研究团队构建了一种超声赋能的智能生物治疗系统,将表达共刺激分子配体OX40L的基因工程菌(BOX)与新型声敏剂纳米粒子(SPNPs)相结合。该系统的核心在于其时空可控性:通过超声辐照,可以触发SPNPs从工程菌表面的按需分离,同时诱导肿瘤细胞发生免疫原性死亡,为T细胞的初步激活创造条件。随后,工程菌持续表达的OX40L配体能够特异性结合已激活T细胞表面的OX40受体,显著增强T细胞的克隆扩增并维持其效应功能。这一设计巧妙地构建了一个“初始激活-信号放大-长效维持”的级联免疫应答过程。

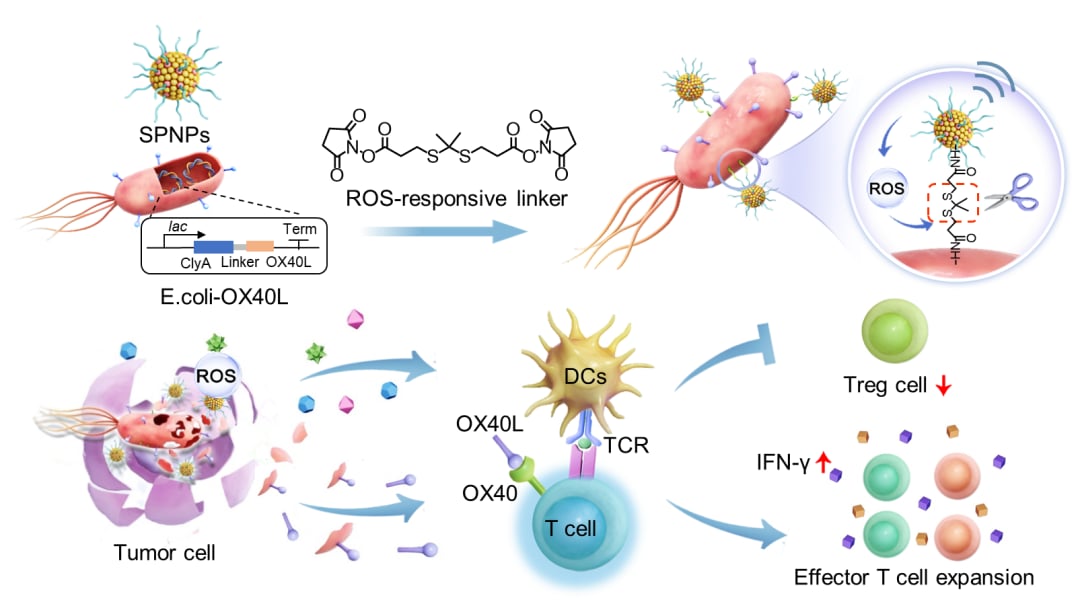
系统设计与工作原理
为了实现这一目标,研究人员首先筛选并开发了一种高性能的半导体聚合物声敏剂(SPNPs)。同时,对细菌进行了基因工程改造,使其能够高效表达OX40L融合蛋白(BOX),作为提供T细胞共刺激信号的关键组分(图1)。
随后,通过ROS响应键将SPNPs共价连接到BOX表面,构建了BOX@SPNPs系统。这种连接方式确保了在超声诱导产生ROS后,SPNPs能够从细菌上精确、按需地分离,从而在肿瘤微环境中发挥各自的作用(图2)。
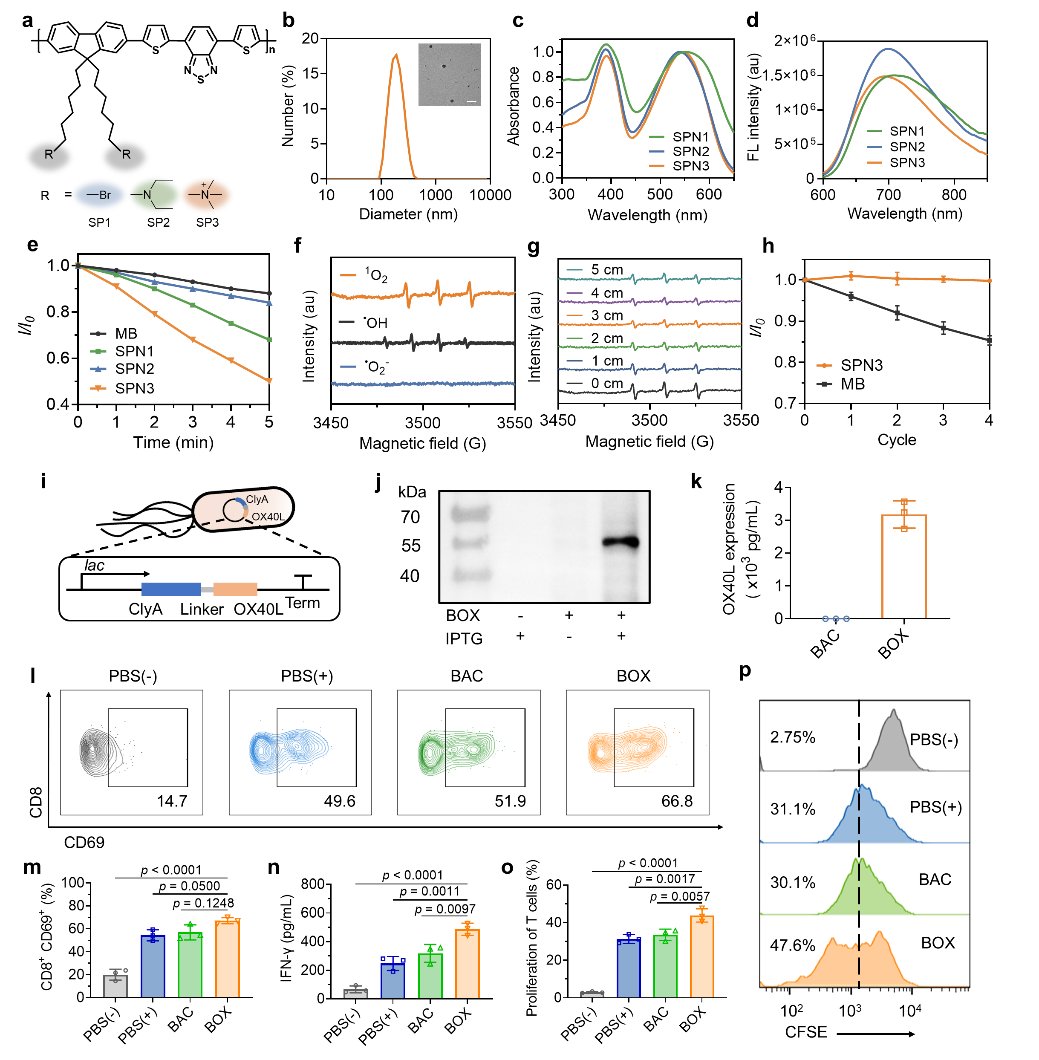
图1 半导体聚合物声敏剂筛选和表达共刺激分子的细菌BOX的表征
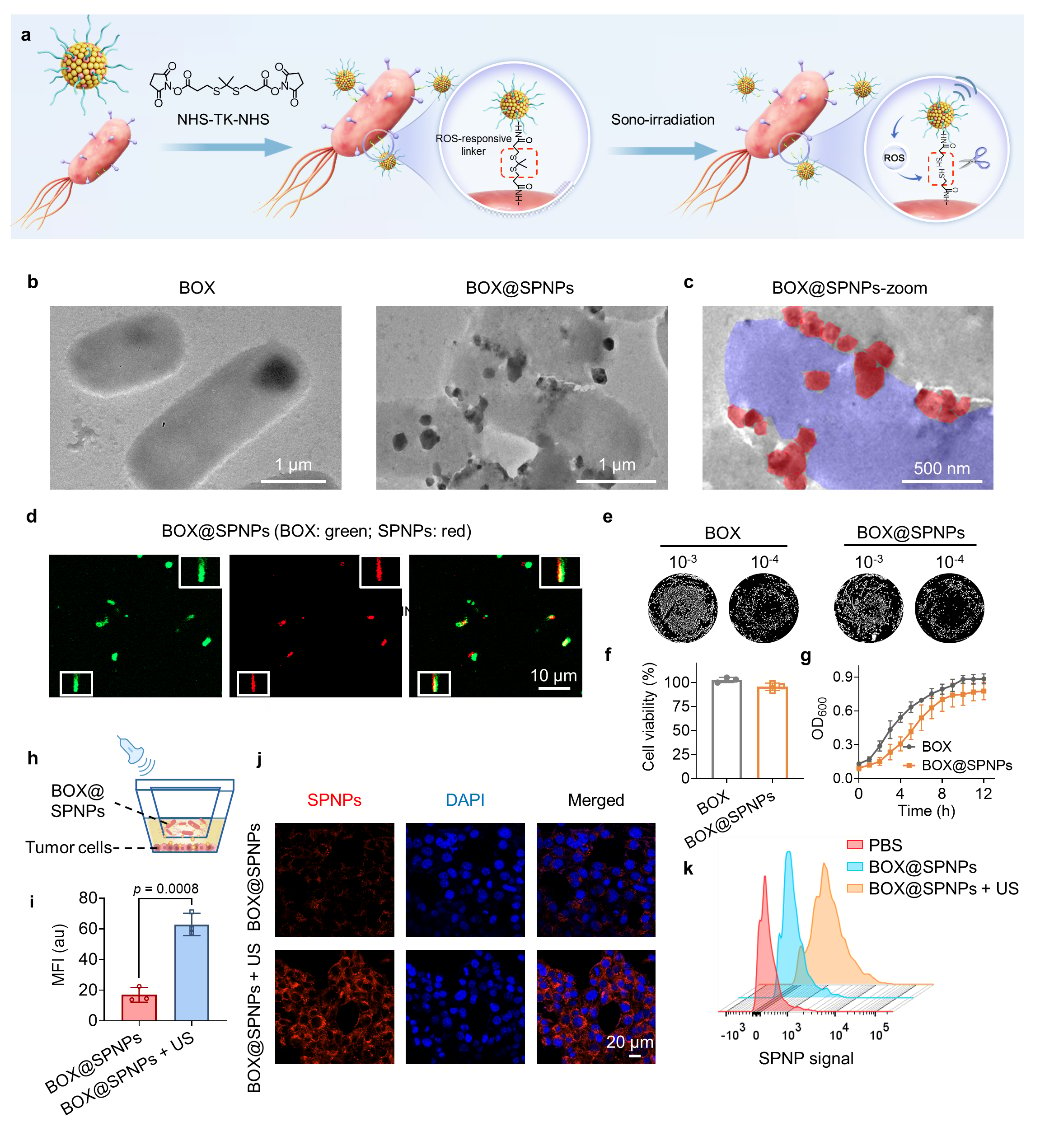
图2 BOX@SPNPs的构建与表征
体内免疫应答与治疗效果
在体内实验中,BOX@SPNPs系统展现出强大的免疫激活能力。超声激活SPNPs诱导的肿瘤细胞ICD促使肿瘤相关抗原(TAAs)和损伤相关分子模式(DAMPs)释放。这些信号与细菌本身的免疫原性协同作用,显著增强了树突状细胞的成熟和细胞毒性T细胞(CTL)的启动。更重要的是,工程菌持续释放的OX40L进一步放大了T细胞的扩增,并维持了其杀伤活性,从而建立了强效且持久的抗肿瘤免疫应答(图3)。
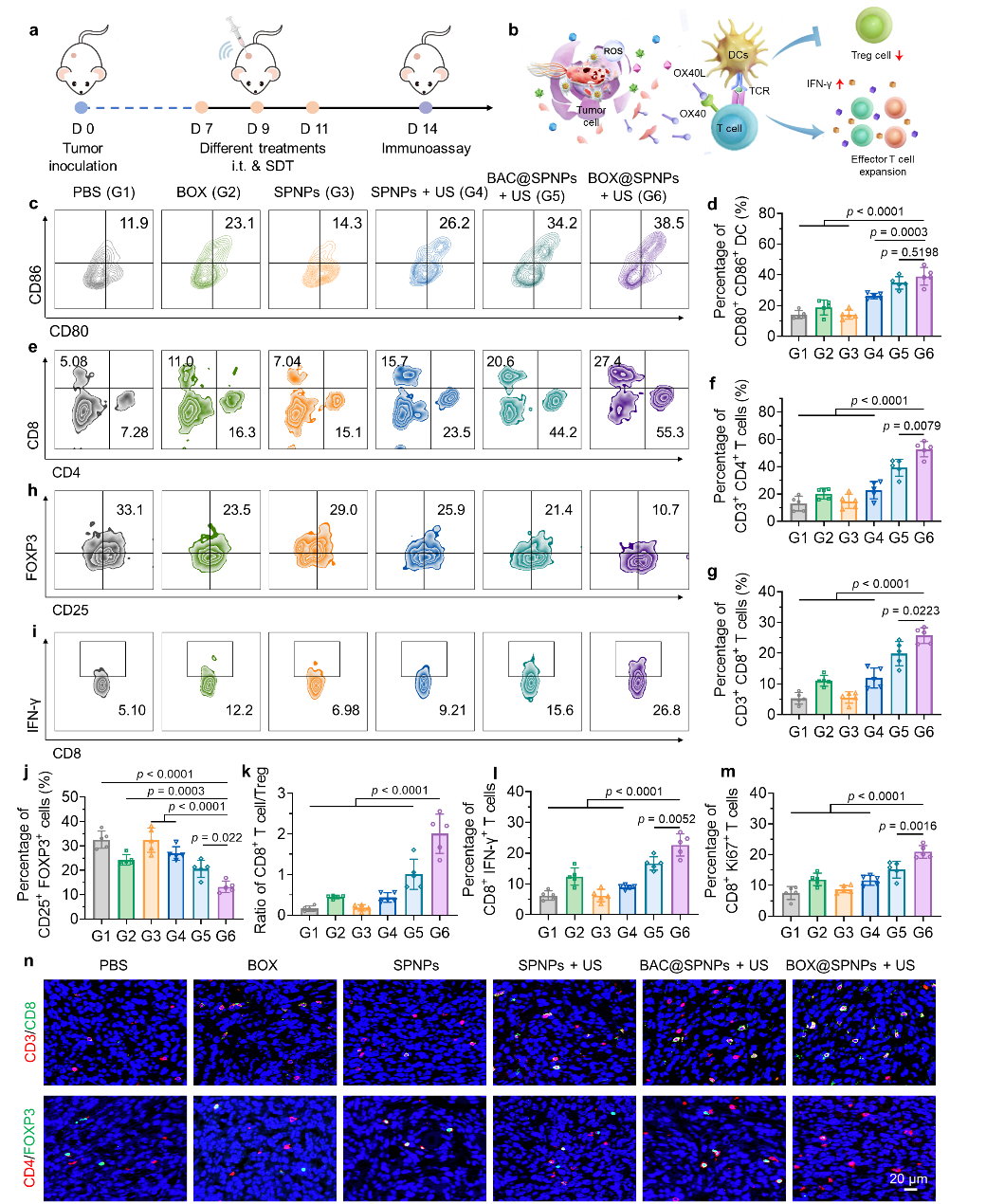
图3 BOX@SPNPs在体内诱导强大的免疫响应
这种级联增强的免疫激活带来了显著的治疗效果。研究结果表明,BOX@SPNPs系统能有效抑制原发肿瘤的生长,并产生“远端效应”,减缓未接受治疗的远处肿瘤的进展(图4)。尤为令人鼓舞的是,该生物杂化系统还能诱导长效的免疫记忆,为抵抗肿瘤转移和复发提供了有力保护(图5)。
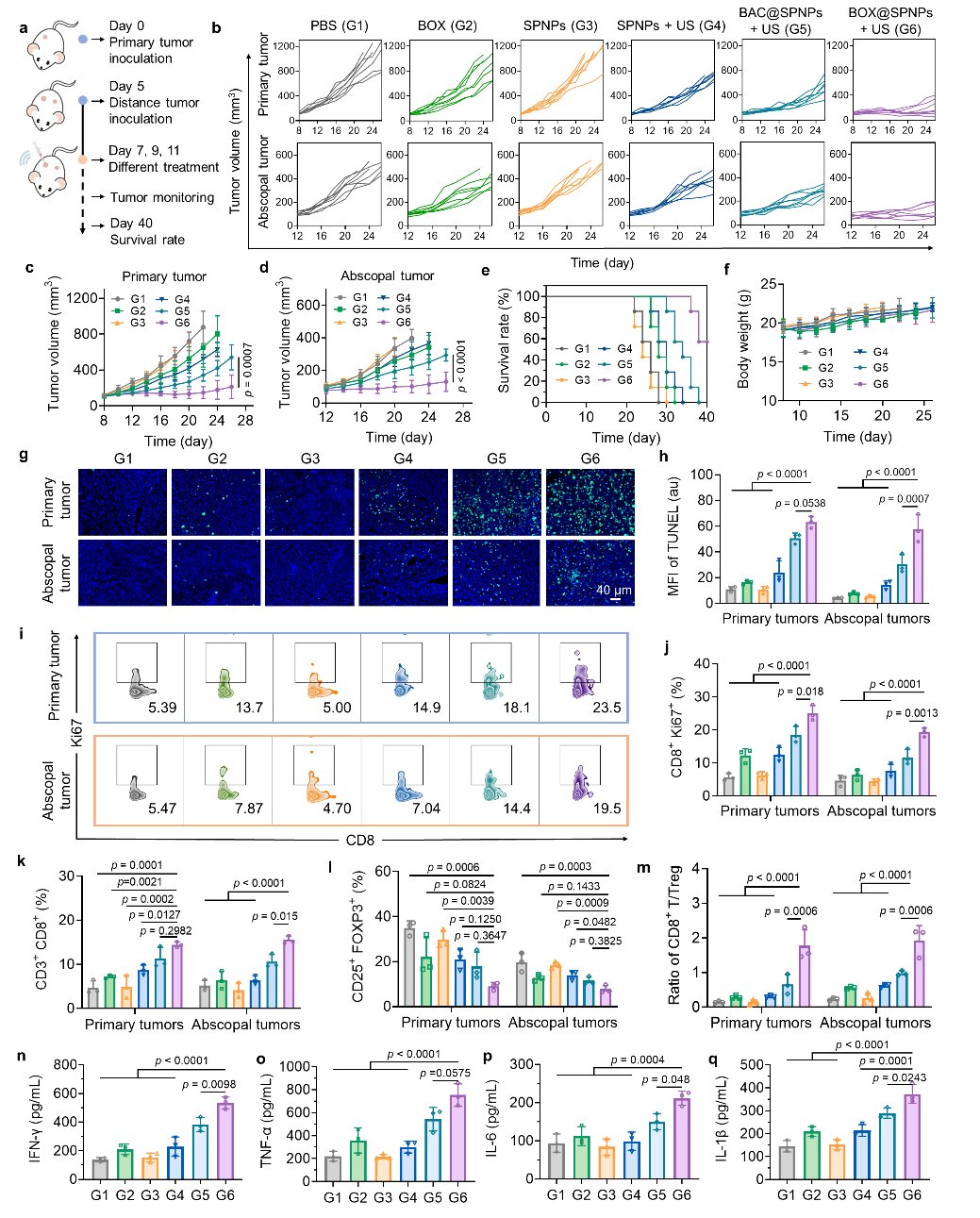
图4 BOX@SPNPs体内抗肿瘤效果
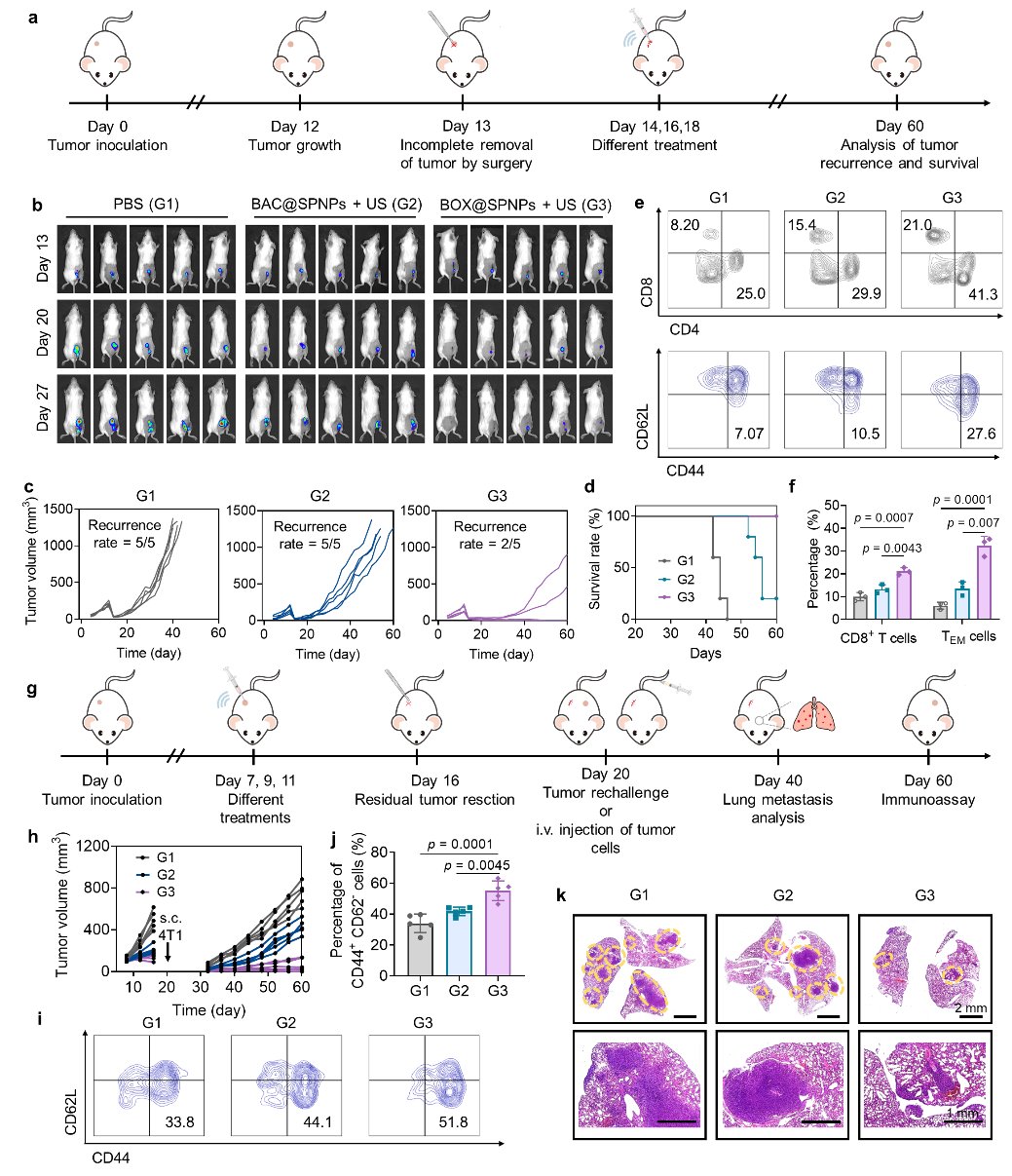
图5 BOX@SPNPs诱导的免疫记忆效应预防肿瘤复发与转移研究
总结与展望
这项研究成功开发了一种新型生物治疗复合系统,通过将表达共刺激分子的基因工程菌与高性能聚合物声敏剂进行创新性整合,实现了对T细胞介导的免疫响应的级联增强,为高效肿瘤声免疫联合治疗提供了新策略。该系统利用细菌天然的肿瘤定植能力,确保了治疗组分在肿瘤内的有效且持续滞留。超声辐照触发的SPNPs分离和ROS产生,不仅直接杀伤肿瘤细胞,更重要的是启动了免疫原性死亡,释放抗原并激活树突状细胞,为T细胞的启动奠定基础。随后,工程菌表达的OX40L进一步“点燃”并维持T细胞的强大活性,形成持久的抗肿瘤免疫屏障。
尽管这类前沿研究尚处于实验室阶段,但其展现出的多维度免疫激活潜力令人振奋。对于正在与癌症抗争的患者而言,了解最新的研究进展固然重要,同时及时获取已获批的、有效的治疗药物同样关键。许多先进的靶向药和免疫治疗药物可能已在海外上市,通过正规渠道进行海外购药或了解仿制药代购信息,是患者寻求更优治疗方案的途径之一。
面对复杂的癌症信息和治疗选择,患者和家属往往需要专业的指导和支持。除了查阅药物信息、诊疗指南等抗癌资讯,利用AI问诊服务获取个性化、辅助性的建议,也能帮助患者更好地理解病情,做出更明智的决策。
这项关于超声赋能基因工程菌与OX40L的研究,为肿瘤免疫治疗开辟了新的视野,期待未来能转化为临床应用,惠及更多患者。