脑肿瘤,特别是儿童型高级别胶质瘤(pHGGs),包括伴H3K27改变的弥漫性中线胶质瘤,是导致儿童癌症相关死亡的主要原因之一,患者确诊后的中位生存期通常不足18个月。在这些肿瘤中,血小板源性生长因子受体α(PDGFRA)基因的变异扮演着关键角色,使其成为高级别胶质瘤(HGG)治疗研究的热门靶点。然而,以往针对PDGFRA的酪氨酸激酶抑制剂(如达沙替尼)在临床试验中效果不佳,部分原因可能在于药物耐受性差以及难以有效穿过血脑屏障。
近期,一项发表在国际知名期刊 Cancer Cell 上的研究(Effective targeting of PDGFRA-altered high-grade glioma with avapritinib)为PDGFRA突变的HGG治疗带来了新的曙光。该研究深入评估了新一代靶向药阿伐替尼(Avapritinib)在HGG样本中的临床前疗效、作用机制、药代动力学特性以及初步的临床应用效果。

PDGFRA变异在高级别胶质瘤中的普遍性
研究团队首先分析了261例pHGG样本的基因数据,发现PDGFRA基因变异相当常见:7.3%的样本存在PDGFRA扩增,5.4%存在PDGFRA突变,另有1.9%同时存在扩增和突变。这一发现强调了靶向PDGFRA作为pHGG潜在治疗策略的重要性。
阿伐替尼在体外研究中展现优越性
为了评估不同PDGFRA抑制剂的有效性,研究人员比较了四种药物(达沙替尼、crenolanib、阿西替尼、阿伐替尼)在携带PDGFRA变异的HGG细胞系中的活性。结果清晰显示,阿伐替尼在抑制肿瘤细胞生长方面表现出最强的能力(图1)。
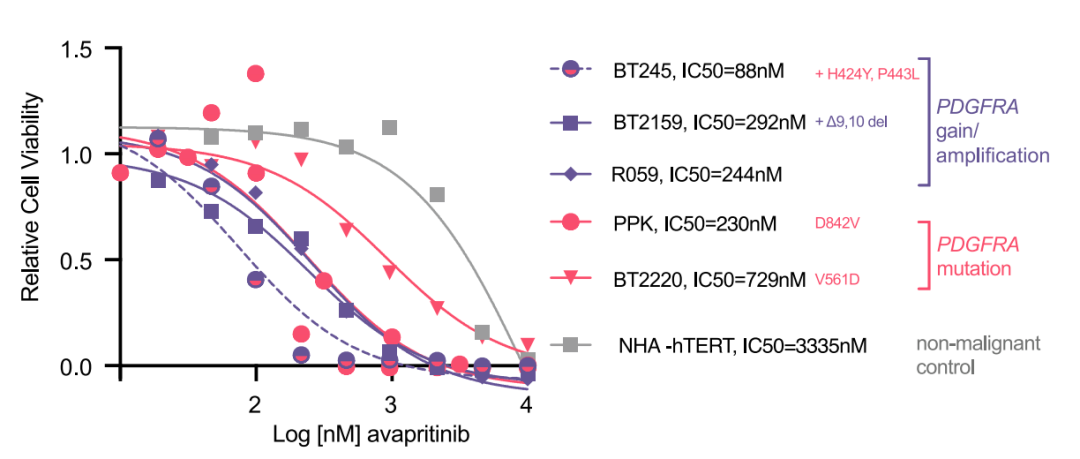
图1: 不同PDGFRA抑制剂处理7天后的剂量反应曲线,显示阿伐替尼效果更优。
阿伐替尼的作用机制与血脑屏障穿透能力
进一步的机制研究证实,阿伐替尼能够高效且持续地抑制多种PDGFRA突变HGG模型中的下游信号传导通路(图2)。对药物在体内的分布进行分析后发现,阿伐替尼能够有效穿过血脑屏障,在脑组织中达到具有治疗活性的浓度,这对于脑瘤治疗至关重要。
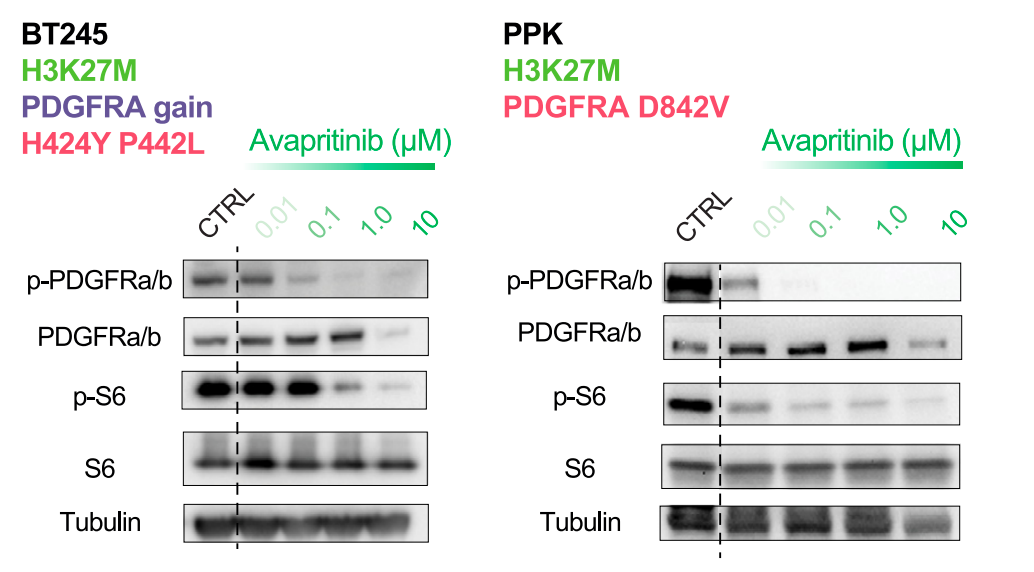
图2: 免疫印迹分析显示阿伐替尼有效抑制PDGFRA及其下游信号分子。
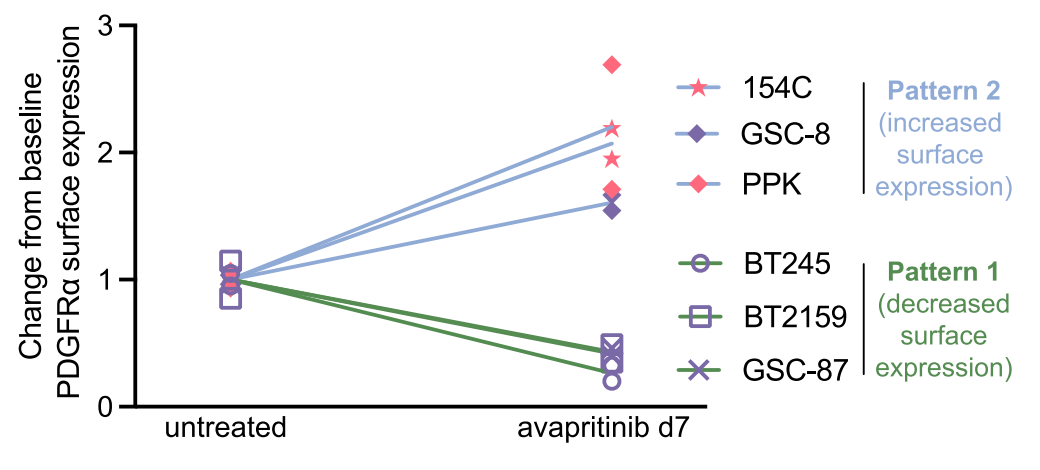
图3: 流式细胞术检测阿伐替尼对PDGFRA表面表达的影响。
临床前模型中的显著疗效
在两种不同的PDGFRA基因变异HGG动物模型中,阿伐替尼治疗均展现出令人鼓舞的效果:不仅有效抑制了PDGFRA信号通路,还显著延缓了肿瘤生长,并延长了模型的生存期(图4)。这些临床前数据为阿伐替尼应用于PDGFRA驱动的HGG患者提供了坚实的理论基础。对于寻求此类前沿靶向药物的患者,了解可靠的海外购药渠道和药物价格信息非常重要。
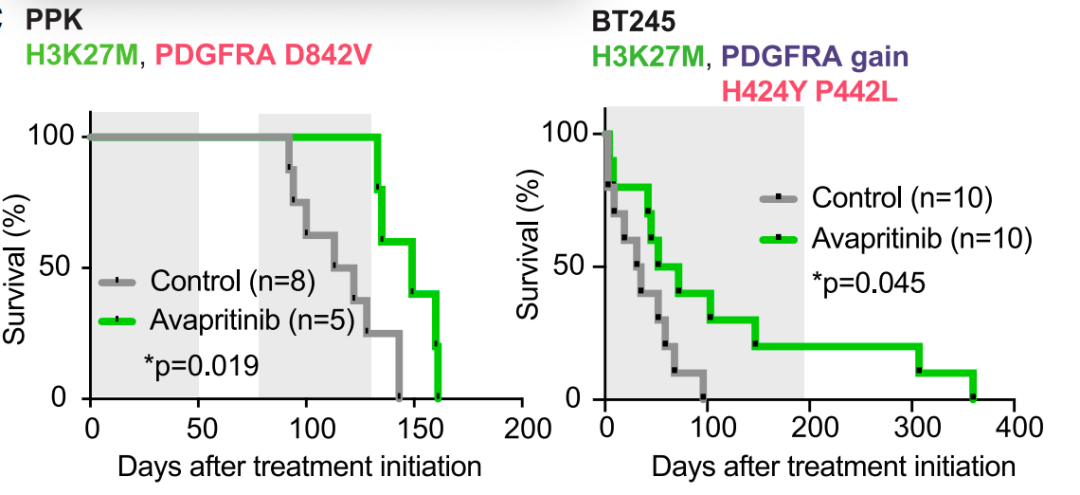
图4: Kaplan-Meier生存曲线显示阿伐替尼显著延长HGG模型生存期。
初步临床数据:真实世界中的希望
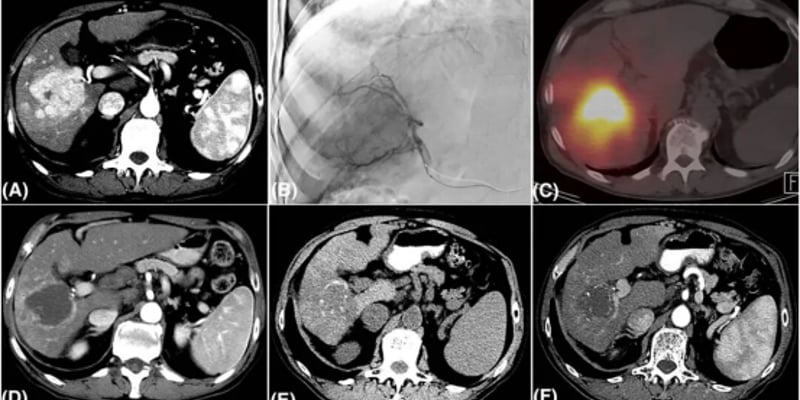
基于积极的临床前结果,研究者收集并分析了来自同情用药项目等的8名接受阿伐替尼治疗的儿童和成人HGG患者的真实世界数据(图5、图6)。安全性方面,阿伐替尼总体耐受性良好。疗效方面,根据RAPNO标准评估,在7名可评估患者中,有3名患者的影像学检查显示肿瘤客观缓解(部分或完全缓解),这些患者的PDGFRA变异类型主要为扩增或18号外显子突变(图7)。
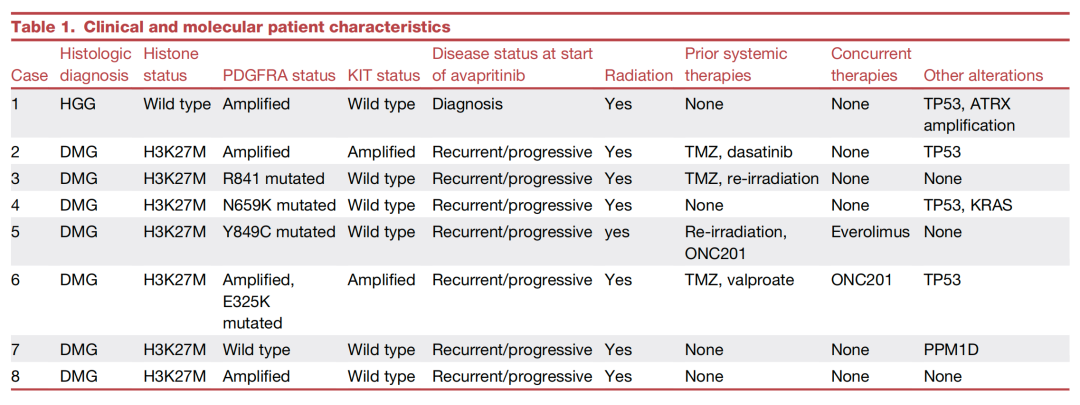
图5: 8名患者的临床特征及分子分型信息。
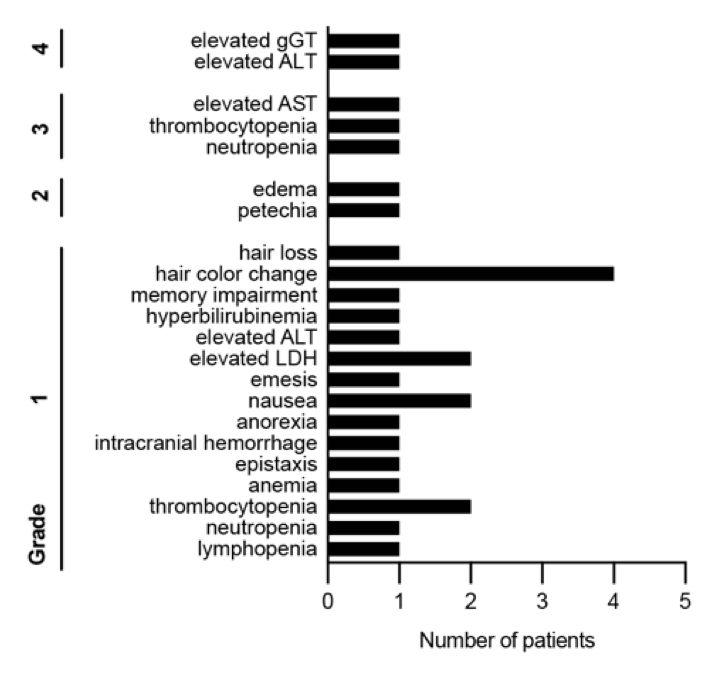
图6: 阿伐替尼治疗期间观察到的不良事件及其发生频率。
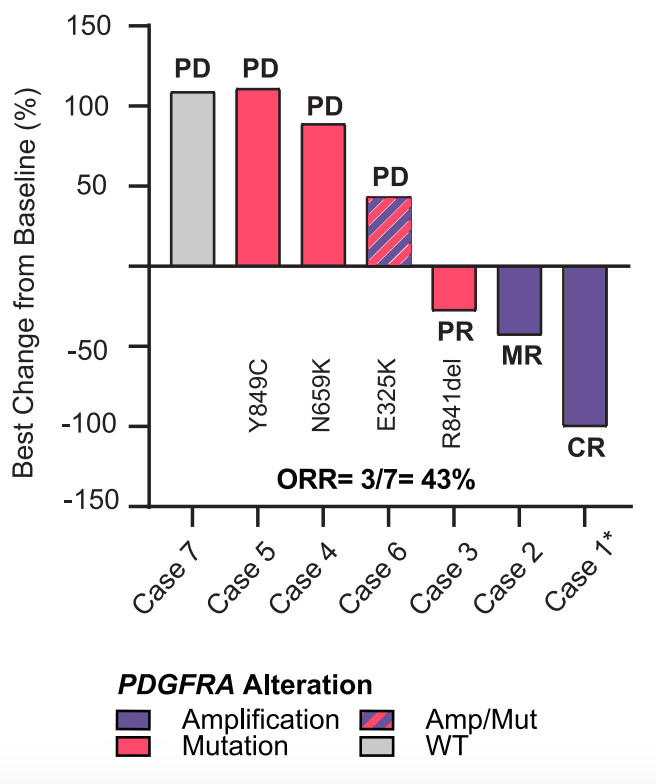
图7:患者接受阿伐替尼治疗后的最佳肿瘤缓解情况(RAPNO标准)。
结论与展望
尽管这项研究的真实世界数据样本量较小,PDGFRA分子分型与阿伐替尼治疗反应之间的确切关系仍需更大规模的临床试验来阐明,但该研究已初步证实了阿伐替尼在治疗携带特定PDGFRA基因变异(尤其是扩增或外显子18突变)的高级别胶质瘤患者中具有重要的潜在临床价值。对于考虑使用阿伐替尼或其他靶向药物的患者,获取全面的药物信息、了解潜在副作用以及探讨个性化治疗方案至关重要。您可以查阅MedFind抗癌资讯获取更多药物信息,或使用MedFind AI问诊服务进行初步咨询。若需了解阿伐替尼代购、仿制药选择或海外购药流程,MedFind也可提供相关支持。