对于广大多发性骨髓瘤患者及其家庭而言,每一次新药的上市都如同点亮了一盏希望的明灯。然而,新药从研发到获批上市,往往需要漫长而严谨的临床试验与审批流程。现在,美国食品药品监督管理局(FDA)发布了一份重磅指南草案,有望显著加速多发性骨髓瘤新药的审批进程,这无疑是行业内的一个里程碑事件。本篇文章将带您深入解读这份指南的核心内容,包括“微小残留病”(MRD)和“完全缓解”(CR)这两个关键概念,它们将如何改变新药的审批格局,又将为患者带来怎样的福音。
多发性骨髓瘤:日益增长的治疗挑战与希望
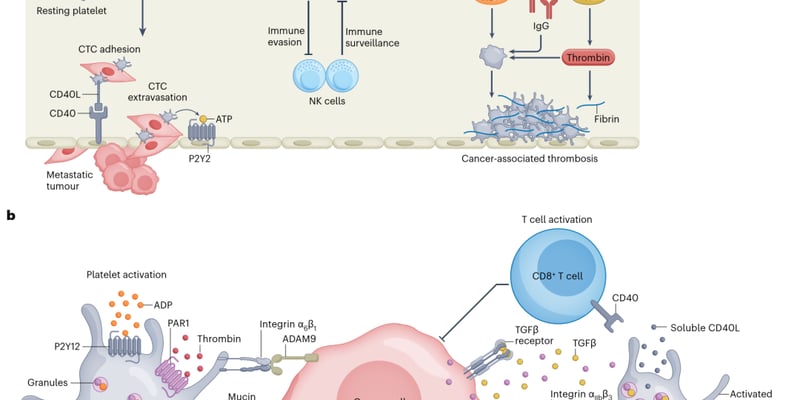
多发性骨髓瘤是一种血液系统恶性肿瘤,它起源于骨髓中的浆细胞。健康的浆细胞负责制造抗体,帮助身体抵御感染,而多发性骨髓瘤患者的骨髓中充满了异常的浆细胞,这些异常细胞不受控制地增殖,产生大量的单克隆免疫球蛋白(M蛋白),干扰正常造血功能,并可能侵蚀骨骼,导致骨痛、骨折、贫血、肾功能损害和免疫力低下等一系列严重问题。这种疾病的特点是异质性强,即便是同一种诊断,不同患者的病情进展和对治疗的反应也可能大相径庭。尽管近年来,随着靶向治疗和免疫治疗等新疗法的不断涌现,多发性骨髓瘤的治疗取得了显著进展,患者的生存期得到延长,但疾病复发和耐药依然是困扰患者和临床医生的一大挑战。因此,如何更快地将创新、有效的药物推向市场,成为全球医学界面临的重要课题。
什么是多发性骨髓瘤?
简单来说,多发性骨髓瘤就像是骨髓里“坏掉”的免疫细胞(浆细胞)在捣乱。这些浆细胞本是身体的“卫士”,负责生产抗体抵御病毒细菌。但当它们癌变后,就会疯狂生长,挤占正常造血空间,导致贫血、免疫力下降。同时,这些坏细胞还会分泌一些物质,让骨头变“脆”,甚至损伤肾脏。这是一种复杂的疾病,每个患者的情况都不同,所以治疗方案也需要个性化定制。
现有治疗的突破与困境
过去几十年,多发性骨髓瘤的治疗经历了革命性的进步。从传统的化疗、放疗,到新一代的蛋白酶体抑制剂、免疫调节剂,再到近年来火热的CD38单抗和CAR-T细胞疗法,许多患者的生存期得到了显著延长,生活质量也有所改善。然而,由于骨髓瘤细胞的顽固性,大多数患者在经历一段缓解期后仍会面临疾病复发,且每次复发后,治疗的难度会进一步增加。耐药性的产生是治疗上的一个巨大挑战,许多患者在经历多种治疗后,最终会面临“无药可治”的困境。因此,加快新药研发和审批,为复发难治患者提供更多选择,成为当务之急。
FDA新规:如何加速多发性骨髓瘤新药审批?
为了应对多发性骨髓瘤治疗的挑战,FDA正在探索更高效的药物审批途径。传统上,新药的获批往往依赖于“总生存期”(Overall Survival, OS)或“无进展生存期”(Progression-Free Survival, PFS)等长期终点数据。这些终点需要长时间的观察才能得出结论,大大延长了新药上市的时间。此次FDA的指南草案,旨在通过引入更早、更敏感的替代终点,在保证药物安全性和有效性的前提下,实现新药的加速审批。
传统审批的“瓶颈”:总缓解率(ORR)的局限性
在此之前,对于多发性骨髓瘤新药的加速审批,主要依据“总缓解率”(Overall Response Rate, ORR)这一早期替代终点。ORR是指接受治疗后,肿瘤体积缩小达到一定程度(部分缓解或完全缓解)的患者比例。ORR在早期临床试验中容易观察和评估,因此被广泛用于加速审批,确实加快了一些新疗法进入市场的速度。然而,随着多发性骨髓瘤治疗手段的不断进步,尤其是新的联合疗法出现后,患者的治疗效果越来越好,很多新药在复发或难治性患者中的ORR都能达到60%-70%以上,在新诊断患者中甚至超过90%。
FDA指出,在这种背景下,仅仅依靠ORR来证明新药具有统计学意义上的显著优势,可能需要规模非常庞大的临床试验,这在实际操作中变得不切实际且效率低下。简单来说,当所有药物都表现出很高的ORR时,就很难通过ORR来区分哪些药物更好、更有效。因此,需要引入更灵敏、更深入的指标来评估新药的真正疗效。
新的关键指标:微小残留病(MRD)和完全缓解(CR)
为了解决ORR的局限性,FDA将目光投向了“微小残留病”(Minimal Residual Disease, MRD)和“完全缓解”(Complete Response, CR)这两个更深层次的疗效指标。
MRD:更灵敏的“侦察兵”
微小残留病(MRD)是指在患者接受治疗后,常规检测方法(如影像学、血常规)已经无法检测到癌细胞,但通过更灵敏的分子生物学或流式细胞术等技术,仍能在骨髓中检测到极少量残存的肿瘤细胞。您可以把MRD想象成一个极其精密的“侦察兵”,它能发现那些隐藏最深、数量最少的癌细胞。如果通过这些高灵敏度的方法也检测不到癌细胞,那么就达到了“MRD阴性”的状态,这通常意味着患者获得了更深层次的缓解,并且预示着更长的无进展生存期(PFS)和总生存期(OS)。
在2024年4月,美国肿瘤药物咨询委员会(ODAC)一致同意,MRD可以作为支持多发性骨髓瘤加速审批的“可接受”终点。这一决定是基于多项临床试验数据的汇总分析,这些分析表明MRD与PFS和OS之间存在显著关联。
当最终指南发布后,FDA将提供具体建议,指导如何设计以MRD为终点的临床试验。MRD的评估标准是在骨髓中检测MRD阴性率,具体方法可通过流式细胞术或基因测序技术,且评估对象是那些已经达到完全缓解(CR)的患者。这意味着,MRD不仅仅是观察癌细胞是否消失,更是看消失得有多“彻底”。
完全缓解(CR):治疗成功的“里程碑”
完全缓解(CR)是指在接受治疗后,患者所有疾病相关症状消失,并且通过所有常规检测手段(包括骨髓活检、血液和尿液检查、影像学检查等)都无法发现任何肿瘤细胞或疾病迹象。CR是多发性骨髓瘤治疗的一个重要“里程碑”,它表明治疗取得了非常好的效果。FDA的指南草案也涵盖了将CR作为临床终点来支持加速审批,因为CR已经被证实与患者的长期生存结果密切相关。达到CR的患者通常会有更好的预后,更长的缓解期。
审批加速机制:为何重要?
将MRD和CR作为加速审批的终点,对于患者而言意义重大:
- 更快接触创新疗法: 缩短药物研发和审批周期,意味着患者能够更早地用上最新的、可能更有效的抗癌药物,尤其对于那些复发难治、治疗选择有限的患者来说,这无疑是雪中送炭。
- 提升临床试验效率: 药企能够更快地获得初步的疗效数据,从而优化研发策略,鼓励更多新药的投入和开发。
- 推动精准治疗发展: 深入研究MRD有助于更好地理解疾病缓解的深度,为未来的个体化精准治疗提供更多依据。
MRD与CR:临床试验中的应用细节
FDA的指南草案不仅提出了使用MRD和CR作为审批终点的可能性,还对这些终点在临床试验中的具体应用提出了指导意见。然而,任何新的方法都会伴随着机遇与挑战,专家对此也有着深入的思考。
FDA对MRD终点的具体建议
这份指南草案明确指出,在设计以MRD为终点的临床试验时,MRD阴性率应通过在骨髓中进行评估来确定。评估方法可以是流式细胞术或基因测序。更重要的是,MRD阴性的评估必须在患者达到完全缓解(CR)之后进行。这意味着,只有当患者的疾病已经进入一个非常良好的状态时,才进一步通过MRD检测来衡量缓解的深度。这种分层评估旨在确保MRD作为终点的可靠性和临床意义。
专家观点与潜在挑战
对于FDA的这一举动,多发性骨髓瘤专家、犹他大学亨茨曼癌症研究所的Manni Mohyuddin博士表示肯定。他认为MRD是“无进展生存期”(PFS)的一个“良好替代指标”。PFS是指患者从治疗开始到疾病进展或因任何原因死亡的时间。MRD阴性通常预示着患者能获得更长的PFS。Mohyuddin博士还赞扬了FDA指南中不建议在维持治疗阶段或针对冒烟型骨髓瘤患者的试验中使用MRD或CR作为终点,因为在这些情况下,MRD和CR的临床意义和预测价值可能不如在活动性疾病治疗中明确。冒烟型骨髓瘤是一种介于正常和活动性多发性骨髓瘤之间的阶段,通常不需要立即治疗,其疾病进展速度较慢。
然而,Mohyuddin博士也表达了一些担忧,主要是基于以往的经验,药企在实际执行指南时可能存在的不足。他举例指出,指南草案中提到试验的对照组应采用“符合美国标准治疗并具有平衡性”的方案,即“对照组应公平合理”。但在现实中,情况往往并非如此。他引用了他和同事在2021年发表的一项系统性回顾研究,该研究评估了多发性骨髓瘤随机对照试验(RCTs)中对照组的质量。结果显示,在49项RCTs中,有7项(14%)在已确定有更优方案后仍将患者纳入次优对照组,另有9项(18%)在对照组劣势数据已明确后仍继续招募患者。这表明,在追求试验效率的同时,确保试验伦理和对照组的合理性至关重要。此外,Mohyuddin博士的另一项2021年研究发现,在多发性骨髓瘤RCTs中,“方案后治疗”(post-protocol therapies)的报告往往不足。在103项RCTs中,仅有43.7%总体和55.3%由药企资助的试验报告了后续治疗情况。这凸显了制定方案后治疗报告指南的必要性。
Mohyuddin博士认为,如果能恰当遵循,FDA提出的建议足以“提供足够的保障,确保MRD作为终点的安全使用”。但他补充道,“不幸的是,历史预示着未来,我怀疑在骨髓瘤领域,行业将继续使用不道德的对照组和糟糕的方案后治疗报告。”这些评论提醒我们,监管机构的指南只是第一步,真正的挑战在于如何在实践中确保其有效执行和合规性。
并非所有情况都适用:适应症的限制
值得注意的是,FDA的指南草案并非一概而论。它明确指出,不建议在维持治疗(maintenance setting)或针对“冒烟型骨髓瘤”(smoldering myeloma)患者的临床试验中,将MRD或完全缓解作为主要终点来支持加速审批。这是因为在这两种情况下,疾病的特征和治疗目标与活动性多发性骨髓瘤不同。维持治疗通常在患者获得缓解后进行,旨在维持疗效、延缓复发;而冒烟型骨髓瘤患者虽然体内有癌细胞,但尚未引起症状,也通常不需要立即治疗。在这些阶段,MRD和CR的临床意义和预测价值可能不如在活动性疾病治疗中那么直接和明确。
对患者意味着什么?MedFind如何助您抓住机遇?
FDA的这份指南草案无疑为多发性骨髓瘤患者带来了新的希望。它意味着,未来可能有更多的创新药物能够以更快的速度进入市场,从而为患者提供更多的治疗选择,特别是对于那些复发难治、寻求突破性疗法的患者。虽然药物获得加速审批后,仍需通过传统的生存期数据来验证其最终的临床益处,但这为患者赢得了宝贵的治疗时间。
更快接触创新疗法:希望的曙光
想象一下,一种能显著提高深度缓解率的新药,如果能提前数年上市,就能让无数患者避免疾病进展,甚至延长生命。MRD和CR作为加速审批终点的引入,正是为了实现这一目标。这不仅是医学研究的进步,更是为患者争取“时间”和“生机”的关键举措。患者将有机会更早地从全球前沿的治疗成果中获益,对抗多发性骨髓瘤的武器库将更加丰富。
药物加速审批后的“验证”机制
FDA的加速审批并非“一劳永逸”。正如其他获得加速审批的药物一样,即使通过MRD或完全缓解数据获得批准,这些疗法仍然需要通过传统的生存期终点(如总生存期OS或无进展生存期PFS)来进一步验证其临床益处。这意味着,药企仍需进行后续的临床试验,收集更长期的随访数据,以最终确认药物的长期疗效和安全性。这种“先加速,后验证”的机制,既保证了新药的及时性,也确保了其长期疗效的可靠性。
MedFind:您身边的抗癌伙伴
面对不断更新的药物信息和复杂的审批政策,患者和家属往往感到无所适从。MedFind作为专业的抗癌信息共享平台,致力于为全球多发性骨髓瘤患者提供最新、最全面的抗癌资讯和药物信息。我们深知时间对癌症患者的重要性,因此紧密关注全球药物审批动态,特别是像FDA此次加速审批指南这样的重大政策变化。通过MedFind平台,您可以:
- 及时了解全球最新抗癌资讯:我们会持续追踪FDA等权威机构的最新指南和药物审批进展。
- 获取详细的药物信息和诊疗指南:帮助您理解药物的作用机制、疗效数据、副作用管理等关键信息。
- 构建便捷的抗癌药品跨境直邮渠道:对于在国内尚未上市但已在国外获批的创新药物,MedFind致力于帮助患者安全、合规地获取所需药物。
- 利用AI辅助问诊服务:帮助您初步解答疑问,更好地与医生沟通,制定适合自己的治疗方案。
FDA的这份指南草案,为多发性骨髓瘤的治疗带来了新的曙光,预示着未来将有更多高效药物更快地惠及患者。MedFind将一如既往地与您并肩作战,作为您获取权威信息、寻求治疗方案、乃至实现抗癌药品跨境直邮的可靠伙伴,共同迎接抗癌路上的每一个挑战。我们坚信,通过不懈的努力和科学的进步,多发性骨髓瘤的治疗将迎来更加光明的未来。