仑伐替尼(Lenvatinib)在肝细胞癌(HCC)治疗中的地位与挑战
肝细胞癌(HCC)是全球范围内发病率和死亡率最高的恶性肿瘤之一,尤其在中国,其负担尤为沉重。对于确诊时已处于中晚期的患者而言,系统性治疗是主要的治疗手段。在过去的几年中,多靶点酪氨酸激酶抑制剂(TKI)如仑伐替尼(Lenvatinib,商品名:乐卫玛/Lenvima)已经确立了其作为晚期HCC一线标准治疗药物的地位。仑伐替尼通过抑制多种受体酪氨酸激酶(包括VEGFR1-3、FGFR1-4、PDGFRα、KIT和RET)发挥抗肿瘤作用,尤其在控制疾病进展和提高客观缓解率方面表现出色。
然而,尽管仑伐替尼疗效显著,但其临床应用面临着一个严峻的挑战:获得性耐药。许多患者在接受仑伐替尼治疗一段时间后,肿瘤会再次进展,即药物失去疗效。耐药性已成为限制仑伐替尼实现更长久、更显著治疗效果的关键瓶颈。因此,深入解析仑伐替尼耐药的分子机制,并寻找能够逆转耐药、恢复药物敏感性的新型治疗靶点,对于改善肝细胞癌患者的预后至关重要。
近期,复旦大学史颖弘、方圆、Tang Zheng、董琼珠等团队合作,在权威期刊《Advanced Science》上发表了题为《DNMT2-m5C-ACLY Axis Promotes Lenvatinib Resistance in Hepatocellular Carcinoma Through Histone Acetylation-Mediated Notch Pathway》的研究论文。这项研究首次揭示了一个全新的耐药信号轴——DNMT2-ACLY-Notch,为克服仑伐替尼耐药提供了极具前景的联合治疗新策略。
破解耐药迷局:DN伐替尼耐药细胞中的表观遗传学变化
为了探究仑伐替尼耐药的深层原因,研究团队首先建立了对仑伐替尼耐药的HCC细胞系。他们观察到一个关键现象:与对药物敏感的亲本细胞相比,耐药细胞内的m5C修饰水平呈现出全面升高的趋势。
m5C(5-甲基胞嘧啶)是一种重要的RNA表观遗传修饰,它广泛存在于信使RNA(mRNA)、核糖体RNA(rRNA)和转运RNA(tRNA)中。这种修饰能够动态调控RNA的稳定性、剪接、核定位和翻译等过程,从而影响细胞的各项生命活动。近年来,m5C修饰与多种癌症的治疗耐药性之间的关联日益受到关注,但此前尚未有研究专门探讨m5C修饰与肝细胞癌中仑伐替尼耐药性之间的关系。
研究进一步锁定了一个关键的“写入者”分子——DNA甲基转移酶2(DNMT2)。DNMT2作为一种RNA甲基转移酶,在仑伐替尼耐药的HCC标本中显著上调。临床数据分析显示,DNMT2的高表达与肝细胞癌患者较差的生存预后密切相关。体外和体内实验均证实,通过下调DNMT2的表达,可以有效克服仑伐替尼耐药性,恢复药物敏感性,表现为减少肝细胞癌细胞的增殖并促进细胞凋亡。
DNMT2-ACLY轴:从RNA修饰到代谢重塑
那么,DNMT2是如何在分子层面驱动耐药性的呢?研究揭示了一个精密的调控网络:
- m5C修饰稳定ACLY mRNA: DNMT2与Y盒结合蛋白1(YBX1)协同作用,通过介导m5C修饰,增强了下游靶分子腺苷三连磷酸柠檬酸裂解酶(ACLY)mRNA的稳定性。mRNA稳定性增加,意味着ACLY蛋白的合成量大幅提高。
- ACLY升高乙酰辅酶A(Ac-CoA)水平: 腺苷三连磷酸柠檬酸裂解酶(ACLY)在细胞代谢中占据核心地位。它负责将线粒体来源的柠檬酸转化为乙酰辅酶A(Ac-CoA)。在癌细胞中,ACLY的过度活跃会促进异常增殖。
- Ac-CoA驱动组蛋白乙酰化: 乙酰辅酶A(Ac-CoA)不仅是代谢的关键枢纽,它在细胞核内还充当乙酰基供体,参与组蛋白乙酰化(Histone Acetylation)。组蛋白乙酰化是一种重要的表观遗传调控方式,它能够松弛染色质结构,从而激活特定基因的表达。
通过这一系列复杂的分子级联反应,DNMT2最终通过m5C修饰和ACLY,提高了细胞内Ac-CoA的水平,进而促进了关键组蛋白的乙酰化修饰。
Notch信号通路:耐药性的最终驱动者
组蛋白乙酰化修饰的升高,最终激活了Notch信号通路。Notch信号通路是一个在细胞分化、增殖和凋亡中发挥关键作用的经典信号通路。在许多癌症中,Notch通路的异常激活与肿瘤的恶性进展和治疗耐药性密切相关。
因此,该研究完整地揭示了仑伐替尼耐药的分子机制:
DNMT2 ↑ → m5C修饰 ↑ → ACLY mRNA稳定 ↑ → ACLY蛋白 ↑ → Ac-CoA ↑ → 组蛋白乙酰化 ↑ → Notch通路激活 → 仑伐替尼耐药。
这一发现不仅阐明了耐药的生物学基础,更重要的是,它指明了潜在的干预靶点,即ACLY。

临床转化前景:ACLY抑制剂联合仑伐替尼的新策略
基于对DNMT2-ACLY-Notch信号轴的深入理解,研究团队提出了一个极具临床价值的联合治疗方案:使用药物抑制ACLY的活性,并联合仑伐替尼进行治疗。
ACLY抑制剂作为有前景的抗癌药物,近年来受到了越来越多的关注。在临床前多种模型中,包括DNMT2高表达的耐药肝细胞癌细胞,采用ACLY抑制剂与仑伐替尼联合治疗,展现出显著增强的抗肿瘤效果。这种联合治疗不仅能有效增强对耐药细胞的杀伤效果,还能在体内模型中显著减轻肿瘤负荷。
这一研究结果为晚期肝细胞癌患者带来了新的希望。如果未来临床试验能够验证“仑伐替尼 + ACLY抑制剂”联合治疗的有效性和安全性,那么对于那些对仑伐替尼产生耐药或预计会产生耐药的患者,尤其是DNMT2高表达的患者,将提供一个突破性的治疗选择。
对于癌症患者和家属而言,了解这些前沿的分子机制和潜在的联合治疗方案至关重要。这有助于在与医生沟通时,更好地理解治疗方案的调整方向,并为未来的个性化治疗做好准备。如果您对复杂的医学报告和治疗方案解读存在疑问,可以利用专业的AI辅助问诊服务,获取更清晰、更专业的指导。
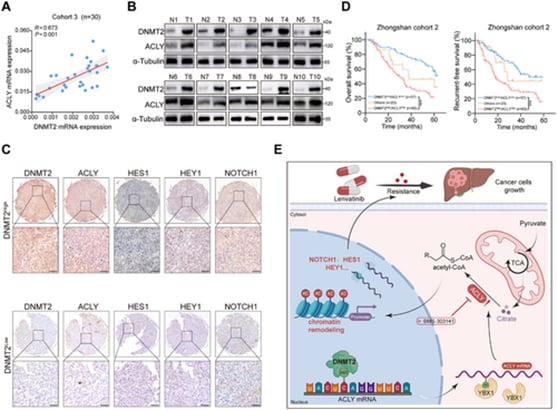
DNMT2和ACLY的共表达与HCC患者的预后较差有关
(图示摘自《Advanced Science》研究论文)
肝细胞癌治疗的未来方向:从单药到精准联合
仑伐替尼作为晚期肝细胞癌的一线治疗基石,其重要性毋庸置疑。然而,随着研究的深入,我们越来越认识到,单一药物难以长期控制复杂的肿瘤进展。未来的治疗趋势必然是精准化和联合化。
1. 生物标志物的指导作用
这项研究强调了DNMT2和ACLY作为潜在生物标志物的重要性。虽然目前这些指标主要用于研究,但它们预示着未来治疗的精准化方向:通过检测患者肿瘤组织中DNMT2和ACLY的表达水平,可以提前预测患者对仑伐替尼的耐药风险,并及时调整治疗策略,例如在治疗初期就考虑联合ACLY抑制剂,以期达到更持久的疗效。
2. 代谢重编程与抗癌治疗
ACLY是肿瘤细胞代谢重编程中的关键酶。肿瘤细胞为了快速增殖,往往需要大量的Ac-CoA来合成脂质和进行组蛋白乙酰化。通过抑制ACLY,可以同时打击肿瘤细胞的代谢和表观遗传调控,这是一种“一石二鸟”的抗癌策略。目前,针对ACLY的抑制剂,如Bempedoic Acid(虽然主要用于降脂,但其抑制ACLY的机制具有抗癌潜力),正在被深入研究。
3. 联合治疗的探索与挑战
除了代谢靶点,仑伐替尼与其他药物的联合应用也是研究热点,尤其是与免疫检查点抑制剂(如PD-1/PD-L1抑制剂)的联合治疗,已在临床上取得了突破。新的“仑伐替尼 + ACLY抑制剂”策略,为克服耐药提供了全新的思路,有望与免疫治疗等其他方案形成多维度的联合,进一步提高晚期HCC的治疗效果。
获取前沿药物与治疗方案的途径
对于肝细胞癌患者而言,时间就是生命。及时获取最新的、国际标准推荐的治疗药物,是提高生存率的关键。由于新药研发和审批存在时间差,许多前沿的联合治疗药物或方案可能尚未在中国大陆上市或纳入医保,这使得患者面临用药选择的困境。
为了确保患者能够及时获得国际前沿的抗癌药物,许多患者和家属会选择通过正规渠道获取海外用药。MedFind致力于提供专业的抗癌药品代购与国际直邮服务,帮助患者安全、便捷地获取包括仑伐替尼在内的多种靶向药物和创新组合药物,确保治疗的连续性。
此外,面对不断更新的临床研究数据和治疗指南,患者需要持续获取可靠的医学信息。MedFind平台提供药物信息、治疗方案解读、临床研究与指南资讯,帮助患者和家属理解复杂的医学知识,做出最有利于自身病情的治疗决策。
总结与展望
复旦大学团队的这项研究,通过揭示DNMT2-ACLY-Notch信号轴在仑伐替尼耐药中的核心作用,为晚期肝细胞癌的治疗带来了重要的理论突破和临床指导意义。它不仅解释了耐药的机制,更重要的是,提出了联合使用ACLY抑制剂来逆转耐药的创新策略。随着未来临床试验的推进,我们有理由相信,这种精准的联合治疗方案将能够有效延长仑伐替尼的有效治疗窗口,最终改善肝细胞癌患者的长期预后。对于正在接受仑伐替尼治疗或面临耐药困境的患者,应积极与主治医生沟通,探讨基于最新研究的个性化治疗调整方案,以期获得最佳的治疗效果。