癌症治疗新突破:重塑肿瘤微环境,激活免疫抗癌潜力
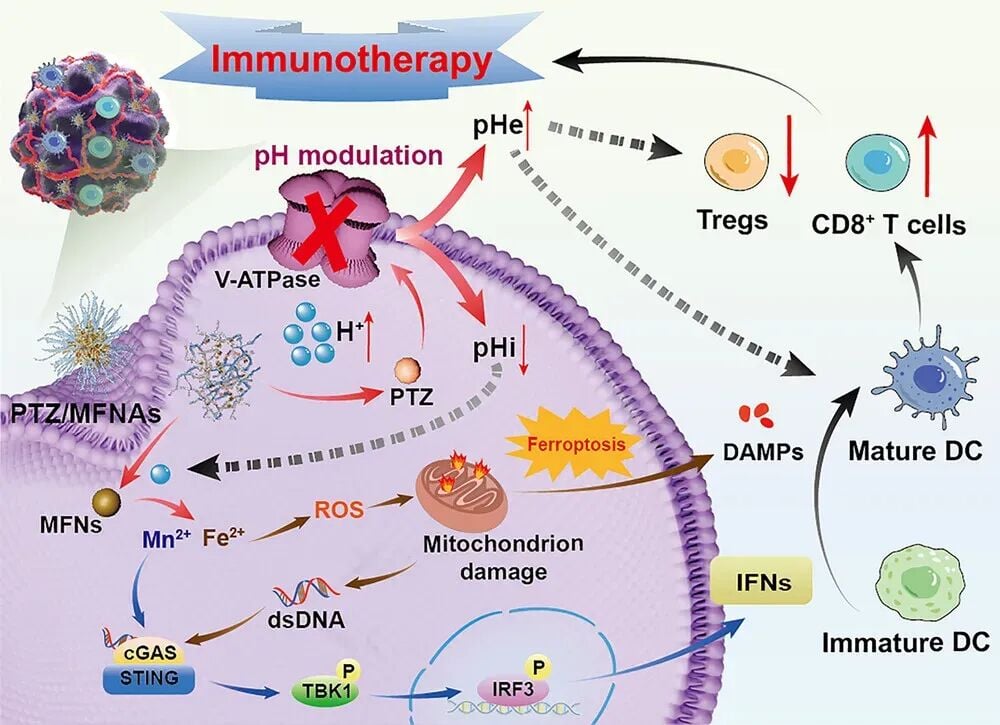
对于正在寻求更有效癌症治疗方案的患者及其家属而言,了解前沿的科研进展至关重要。传统的免疫治疗虽然取得了巨大成功,但许多患者因肿瘤微环境(TME)的免疫抑制特性而疗效不佳。近期,中国药科大学孙晓莲教授和南京医科大学王守巨教授团队在《Small》期刊上发表了一项突破性研究,提出了一种名为PTZ/MFNAs的复合递送系统,该系统巧妙地利用了常用药物泮托拉唑(Pantoprazole,一种质子泵抑制剂)与铁锰纳米粒(MFNs)的协同作用,通过重塑癌细胞内外的pH环境,显著增强了铁死亡效应并激活了关键的cGAS-STING免疫通路,为提升癌症免疫治疗效果提供了全新的策略。
这项研究的核心在于解决肿瘤微环境中的一个关键难题:酸性失衡。通过靶向调控肿瘤细胞的pH值,PTZ/MFNAs系统不仅能增强纳米金属催化治疗的效果,还能有效逆转TME的免疫抑制状态,为未来联合治疗方案奠定了基础。了解最新的癌症治疗方案和药物信息,患者可以参考 权威的药物信息与治疗指南,以便更好地与医生沟通。
肿瘤微环境的“酸性陷阱”:为何削弱免疫治疗?
肿瘤组织具有快速增殖和代谢旺盛的特点,这导致其微环境与正常组织存在显著差异。其中,pH值的失衡是限制多种抗癌疗法(包括免疫治疗)的关键因素。
1. 癌细胞的代谢特征与酸性环境
癌细胞倾向于进行“有氧糖酵解”(Warburg效应),产生大量乳酸和质子(H+)。这些质子需要被排出细胞外,以维持癌细胞自身的生存和代谢。肿瘤细胞中过度表达的质子外排转运蛋白,尤其是液泡型ATP酶(V-ATPase),扮演了“质子泵”的角色,将质子泵出细胞外。
2. 细胞内外的pH梯度
这种质子外排机制造成了独特的pH梯度:
- 细胞外微环境(TME):变得高度酸化(低pH值)。
- 细胞内环境:保持相对中性(正常pH值)。
这种“细胞外酸、细胞内中性”的状态对癌症治疗极为不利。酸性的TME会直接抑制免疫细胞(如T细胞和自然杀伤细胞)的活性,促进免疫抑制性细胞(如调节性T细胞)的聚集,形成强大的免疫屏障,使免疫检查点抑制剂等药物效果大打折扣。
3. 限制纳米金属疗法潜力
许多基于金属离子的纳米疗法(如铁死亡诱导剂)需要酸性环境才能释放金属离子并发挥作用。然而,细胞内相对中性的环境不利于金属离子在癌细胞内部的有效释放,从而削弱了治疗效果。
PTZ/MFNAs系统:双重调控机制深度解析
为了克服上述“酸性陷阱”,研究团队设计了PTZ/MFNAs复合递送体系。该系统将质子泵抑制剂泮托拉唑(PTZ)与铁锰纳米粒(MFNs)共同包裹在一种酸响应性聚合物中,利用纳米技术实现肿瘤靶向递送。
1. 靶向富集与可控释放
该纳米组装体利用肿瘤组织的高通透性和滞留效应(EPR效应),在血液循环中保持稳定,避免金属离子提前释放。一旦到达肿瘤部位,酸响应性聚合物开始降解,释放出关键组分。
2. 泮托拉唑(PTZ)的pH重塑作用
泮托拉唑是一种临床上广泛使用的质子泵抑制剂,主要用于治疗胃酸过多。在该系统中,PTZ的作用是双重的:
- 抑制V-ATPase:PTZ抑制癌细胞表面的V-ATPase活性,阻断质子外排。
- 提高细胞内酸度:质子无法排出,导致癌细胞内部的pH值下降,变得更酸。
- 中和细胞外酸性:减少质子外排,有助于缓解TME的酸性状态,逆转免疫抑制。
细胞内酸度的提高是关键一步,它不仅促进了纳米组装体的进一步解体,加速了铁离子和锰离子的释放,还为后续的铁死亡诱导创造了有利条件。
3. 铁锰离子的协同抗癌机制
释放的铁离子(Fe²⁺)和锰离子(Mn²⁺)发挥了强大的协同作用:
- 诱导铁死亡(Ferroptosis):亚铁离子(Fe²⁺)是芬顿反应的关键催化剂,它能与过氧化氢反应,大量生成活性氧(ROS)。ROS的积累导致脂质过氧化,最终诱导癌细胞发生铁死亡——一种依赖铁的程序性细胞死亡方式。
- 激活cGAS-STING通路:锰离子(Mn²⁺)能够激活环鸟苷酸-腺苷酸合成酶(cGAS)。当癌细胞因铁死亡而受损时,会释放出双链DNA(dsDNA)。cGAS识别dsDNA后,在Mn²⁺的增强作用下,激活干扰素基因刺激因子(STING)通路。
对于复杂的治疗选择和机制,患者可以利用 AI辅助问诊服务 进行初步了解和咨询,以便更好地理解这些前沿概念。
铁死亡与cGAS-STING:免疫治疗的新焦点
PTZ/MFNAs系统的成功之处在于,它不仅直接杀伤了癌细胞(通过铁死亡),更重要的是,它将这种细胞死亡转化为强大的抗肿瘤免疫信号。
1. 免疫原性细胞死亡(ICD)
铁死亡被认为是一种免疫原性细胞死亡(ICD)模式。当癌细胞发生铁死亡时,会释放出危险信号分子(DAMPs),这些信号分子能够招募和激活树突状细胞(DCs)等抗原呈递细胞,启动适应性免疫应答。
2. cGAS-STING通路的免疫放大效应
cGAS-STING通路是机体固有免疫的关键组成部分。一旦被激活,它会触发I型干扰素(IFNs)等细胞因子的产生。这些细胞因子能够:
- 增强免疫细胞的活性:促进T细胞的成熟和活化。
- 形成“炎症”TME:将原本“冷”的免疫抑制性肿瘤转化为“热”的、有利于免疫攻击的环境。
因此,PTZ/MFNAs系统通过“重塑pH环境”→“诱导铁死亡”→“激活cGAS-STING”的级联反应,实现了对肿瘤的直接杀伤和对免疫系统的间接激活,最终达到抑制肿瘤生长和转移的目的。
纳米递送技术的优势与临床转化潜力
纳米技术在癌症治疗中的应用,主要是为了解决传统疗法中药物靶向性差、全身毒性高以及体内清除快等问题。
1. 提高靶向性和生物利用度
PTZ/MFNAs的纳米组装体结构保证了药物在血液循环中的稳定性,避免了铁离子和锰离子在到达肿瘤前被快速清除或在健康组织中释放。通过EPR效应,纳米粒能够优先在肿瘤组织富集,实现高浓度、高选择性的药物递送。
2. 降低全身毒副作用
由于药物主要集中在肿瘤部位释放,相比于全身性给予高剂量金属离子,纳米递送系统能够显著降低对健康器官的毒副作用,提高了治疗的安全性。
这项研究为克服肿瘤微环境介导的免疫抑制提供了新的思路,特别是将临床上常用的药物(如泮托拉唑)与前沿的纳米催化和免疫激活策略结合起来,展现了极大的临床转化潜力。虽然目前仍处于临床前研究阶段,但其机制的创新性预示着未来可能出现更高效的癌症联合治疗方案。
3. 药物获取与未来展望
随着癌症治疗研究的不断深入,许多创新药物和治疗方案正在全球范围内加速发展。对于尚未在国内上市的创新药物,患者通常需要通过 国际直邮代购服务 获取,以确保及时接受最新的治疗。PTZ/MFNAs系统代表了肿瘤治疗领域的一个重要方向:利用多功能纳米平台,实现对肿瘤微环境的精确调控,从而最大化免疫治疗的疗效。
未来,研究人员将继续探索如何将这种pH调控策略与现有的免疫检查点抑制剂(如PD-1/PD-L1抑制剂)相结合,以期为那些对传统免疫疗法不敏感的患者带来新的希望。