透明细胞肾细胞癌:一个全球性的健康挑战
透明细胞肾细胞癌(ccRCC)是肾癌中最常见且最具侵袭性的亚型,占所有肾癌病例的70%以上。全球每年有超过43万例新发肾细胞癌病例,其高发病率和复杂的治疗挑战使其成为一个严峻的全球性健康问题。ccRCC的显著特征之一是其细胞内脂质和糖原的异常积累,这表明脂质代谢重编程在肿瘤的发生、发展、转移以及对现有抗癌治疗的抵抗中扮演着核心角色。理解并靶向这些代谢异常,对于开发更有效的治疗策略至关重要。
肿瘤微环境与脂质代谢:PAT的隐秘作用
近年来,研究发现肿瘤周围脂肪组织(PAT)并非被动的旁观者,而是肿瘤微环境中的一个活跃组成部分,通过与ccRCC肿瘤的双向“对话”显著影响肿瘤进展。PAT能够经历“褐变”过程,释放大量乳酸,为肿瘤的生长、侵袭和治疗抵抗提供“燃料”。反之,ccRCC细胞也会分泌如甲状旁腺激素相关蛋白(PTHrP)等因子,诱导PAT从能量储存的白色脂肪转化为能量燃烧的棕色脂肪,进一步促进肿瘤进展。这种肿瘤与脂肪组织的相互作用形成了一个恶性循环,加速了ccRCC的病程。
尽管我们对ccRCC独特的脂质负载表型有了初步认识,但PAT衍生的脂质代谢物如何具体影响肿瘤代谢和侵袭性的机制,仍是一个未解之谜。阐明这些机制对于识别这种顽固性恶性肿瘤的治疗脆弱性至关重要。
LPE18:1:驱动透明细胞肾细胞癌进展的关键脂质代谢物
溶血磷脂酰乙醇胺(LPE)是一类由磷脂酰乙醇胺水解产生的脂质代谢物,在调节细胞膜动力学和信号级联反应中发挥着重要作用。先前的研究已表明LPE在卵巢癌等多种癌症中参与调节细胞迁移和侵袭,并与脂质代谢和脂肪形成密切相关。然而,LPE在透明细胞肾细胞癌(ccRCC)中的具体作用,特别是其特定种类和下游效应物,尚不清楚。
河北医科大学杨展、中国医科大学陈小楠及石家庄市人民医院Qu Changbao团队在《Signal Transduction and Targeted Therapy》期刊上发表的最新研究,取得了突破性进展。该研究发现,溶血磷脂酰乙醇胺18:1(LPE18:1)——一种在PAT和ccRCC患者动脉血中富集的脂质代谢物——是肿瘤生长和脂质沉积的关键驱动因素。这表明LPE18:1可能成为连接PAT与ccRCC侵袭性的关键桥梁。

LPE18:1-CAPZA1-SIRT6-ACAT2信号轴:重塑脂质代谢的分子机制
为了深入探究LPE18:1如何驱动ccRCC,研究团队进行了多组学分析和一系列功能研究,揭示了一个精密的信号级联反应:
CAPZA1的上调与SIRT6的稳定
研究发现,LPE18:1能够显著上调F-肌动蛋白封盖蛋白亚单位α-1(CAPZA1)的表达。CAPZA1是一种调节细胞骨架动力学和细胞运动的关键蛋白,在癌症中具有上下文依赖的作用。在ccRCC中,生物信息学分析已表明CAPZA1过表达与预后不良、疾病晚期和生存率降低相关。这项新研究进一步阐明了CAPZA1的功能意义:它通过抑制蛋白酶体降解,募集泛素特异性肽酶48(USP48),从而稳定NAD依赖性蛋白去乙酰化酶Sirtuin-6(SIRT6)。
SIRT6是一种多功能的蛋白去乙酰化酶,参与调控DNA修复、炎症反应和脂质代谢等多种生物过程。虽然SIRT6在某些癌症中被认为是肿瘤抑制因子,但越来越多的证据表明,在特定情况下,它也可以作为肿瘤启动子,例如在肝内胆管癌中促进谷氨酰胺代谢重编程。在ccRCC中,LPE18:1通过CAPZA1介导的机制稳定了SIRT6,使其在肿瘤进展中发挥促癌作用。
SIRT6促进ACAT2表达,驱动胆固醇积累
升高的SIRT6在表观遗传层面上发挥作用,促进了乙酰辅酶A乙酰转移酶2(ACAT2)的表达。ACAT2是一种关键的胆固醇酯化酶,负责将游离胆固醇转化为胆固醇酯,并促进脂滴的形成。脂滴的异常积累和游离胆固醇的过度酯化是ccRCC侵袭性的标志性特征。通过促进ACAT2的表达,SIRT6将肿瘤细胞的脂质代谢转向游离胆固醇的积累,为肿瘤的快速增殖和侵袭提供了必要的“燃料”。
因此,该研究首次描绘了LPE18:1通过CAPZA1–USP48轴稳定SIRT6,进而促进ACAT2表达,最终导致胆固醇积累和ccRCC进展的完整信号通路。这一发现为理解ccRCC的代谢重编程提供了深刻的机制见解。
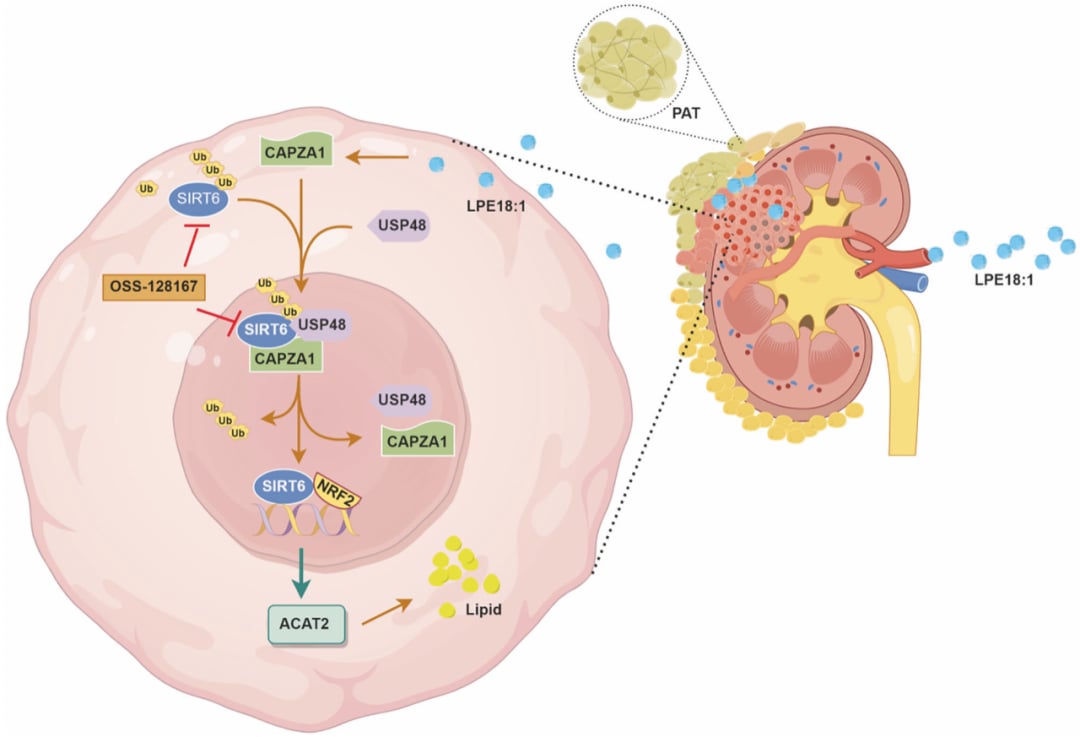
文章模式图(图源自Signal Transduction and Targeted Therapy)
临床意义与潜在治疗靶点
这项研究的临床意义重大。在ccRCC患者队列中,CAPZA1和SIRT6的水平与肿瘤晚期分期和不良预后显著相关,这进一步验证了它们在疾病进展中的关键作用,并提示它们可能作为ccRCC的预后生物标志物。
更令人振奋的是,研究表明,通过遗传手段或药物抑制CAPZA1/SIRT6轴,可以有效逆转LPE18:1诱导的脂质沉积和异种移植模型中的肿瘤进展。值得注意的是,SIRT6抑制剂OSS-128167能够结合CAPZA1,靶向该轴的缺失可以显著抑制ccRCC细胞的生长。这为开发针对ccRCC的创新治疗策略提供了坚实的理论基础和潜在的药物靶点。
对于透明细胞肾细胞癌患者而言,了解最新的研究进展和治疗靶点至关重要。MedFind平台提供全面的药物信息、治疗方案解读、临床研究与指南资讯,帮助患者及其家属更好地理解疾病,做出明智的治疗选择。
展望未来:靶向脂质代谢重编程的治疗前景
这项研究不仅揭示了PAT衍生的脂质代谢物驱动的信号级联如何重编程ccRCC中的脂质代谢,更重要的是,它确定了CAPZA1/USP48/SIRT6轴是代谢性恶性肿瘤的可行治疗靶点。这意味着,通过精准干预这一信号通路,我们有望开发出针对透明细胞肾细胞癌的新型靶向疗法。
未来的研究可以进一步探索OSS-128167等SIRT6抑制剂在临床前和临床阶段的疗效和安全性,以及与其他治疗手段(如免疫疗法、化疗)联合应用的潜力。此外,深入研究LPE18:1的生成和调控机制,也有助于开发阻断其作用的策略。
随着对透明细胞肾细胞癌发病机制的深入理解,更多靶向药物正在研发中。对于患者而言,及时获取这些创新药物是改善预后的关键。MedFind提供抗癌药品代购与国际直邮服务,确保患者能够便捷地获得全球前沿的抗癌药物。
总之,这项研究为透明细胞肾细胞癌的治疗带来了新的希望。通过靶向LPE18:1–CAPZA1–SIRT6–ACAT2信号轴,我们有望更有效地控制肿瘤进展,改善患者的预后和生活质量。面对复杂的治疗选择和不断更新的医学信息,患者往往需要专业的指导。MedFind的AI辅助问诊服务可以为患者提供个性化的初步咨询,解答疑问,并引导患者进一步寻求专业医疗建议。
持续关注最新的医学研究进展,对于癌症患者及其家属来说至关重要。这些突破性的发现,正是我们对抗癌症、争取更长更好生存的关键。





