什么是成人T细胞白血病/淋巴瘤(ATL)?
成人T细胞白血病/淋巴瘤(Adult T-cell Leukemia/Lymphoma,简称ATL)是一种罕见且极具侵袭性的血液系统恶性肿瘤。对于许多患者和家属而言,这是一种充满挑战的疾病,其治疗过程复杂且预后不佳。这种疾病的“罪魁祸首”是一种名为人类T细胞白血病病毒1型(HTLV-1)的逆转录病毒。然而,并非所有HTLV-1感染者都会患病,据统计,只有约5%的病毒携带者会在感染数十年后,最终发展为ATL。这漫长的潜伏期背后,隐藏着一场病毒与人体免疫系统、基因、表观遗传之间复杂的“拉锯战”。
近期,发表于《Cancer Science》的一篇综述文章,系统地梳理了ATL在基因组、表观基因组和转录组层面的最新研究进展,为我们揭示了这种疾病从病毒感染到最终癌变的完整分子图谱,并为开发新的治疗策略和预后模型指明了方向。

ATL的发病机制:病毒、基因与表观遗传的“共谋”
ATL的发生并非一蹴而就,而是一个多步骤、长时间累积异常的结果。这个过程始于HTLV-1病毒的感染,它主要攻击我们免疫系统中的CD4+ T细胞。病毒将其遗传物质整合到宿主细胞的基因组中,如同一个“定时炸弹”。
病毒中的关键蛋白,如Tax和HBZ,会像黑客一样,篡改宿主细胞正常的信号传导和基因表达程序。它们通过增强细胞的存活能力、促进其无限增殖,并帮助其逃避免疫系统的监视,从而使得被感染的细胞能够在体内长期潜伏。然而,仅仅病毒感染还不足以引发癌症。在数十年的潜伏期内,这些被感染的细胞还会不断积累各种遗传学(基因突变)和表观遗传学(基因表达调控)的异常。当这些异常累积到一定程度,量变引发质变,最终导致ATL的爆发。
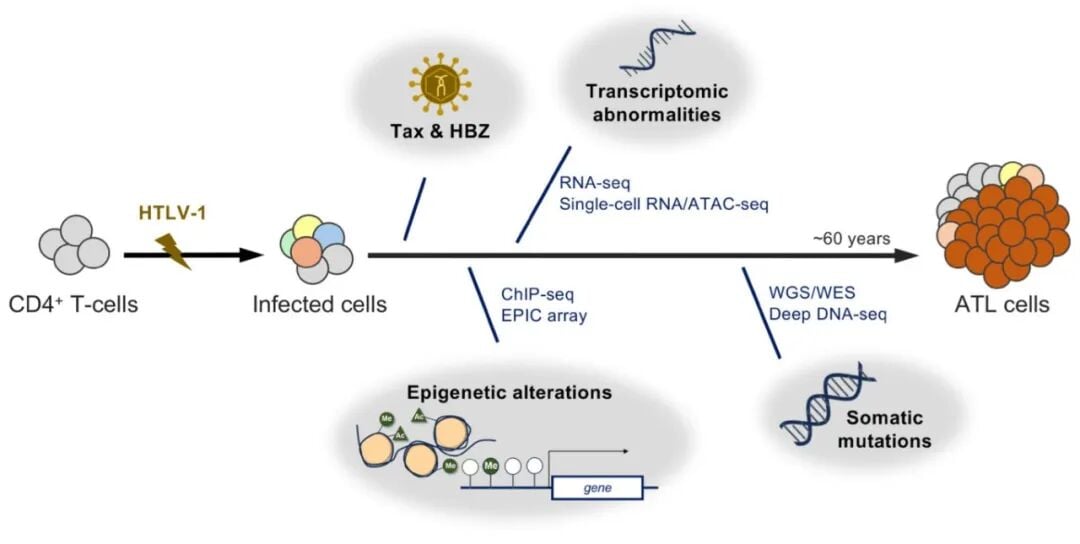
图1. 从HTLV-1感染到ATL发生的异常累积级联反应
ATL的分子异质性:为何每个患者都独一无二?
通过对大量ATL病例进行全基因组测序,科学家们发现ATL细胞的基因组极不稳定,充满了大量的突变、结构变异和拷贝数变异。与其他癌症不同,ATL没有一个明确的、共通的“明星”驱动突变,这使得靶向治疗的开发变得异常困难。
关键信号通路的失控
研究发现,超过90%的ATL病例中,T细胞受体(TCR)和NF-κB信号通路都出现了基因突变。这两个通路在正常T细胞的激活和功能中扮演着核心角色,但在ATL细胞中,这些突变导致通路被持续异常激活,就像一个被卡住的油门,驱动细胞不停地增殖。常见的突变基因包括PLCG1、PRKCB、CARD11、VAV1等。
除了上述核心通路,其他多个信号通路,如JAK–STAT、NOTCH和PI3K-AKT通路,也常常因为基因突变或拷贝数异常而被激活,共同构成了一个复杂的、失控的增殖信号网络。
免疫逃逸的“隐身术”
为了在体内生存和扩张,ATL细胞还进化出了多种逃避免疫系统攻击的“伎俩”。这体现在多个与免疫功能相关的基因上,例如,通过PD-L1的扩增来抑制免疫细胞的活性,或者通过改变MHC I类分子(HLA-A, HLA-B)的表达,让免疫细胞无法识别自己。
克隆演化的动态过程
ATL的另一个显著特征是其高度的异质性。HTLV-1病毒整合到宿主基因组的位置是随机的,每个整合事件都标志着一个独特的细胞“克隆”的诞生。在漫长的潜伏期内,这些不同的克隆会各自积累不同的基因突变,并相互竞争。最终,那些获得了最强生存和增殖优势的克隆会脱颖而出,发展成为恶性肿瘤。
纵向研究甚至发现,在患者尚未出现任何症状的癌前阶段,体内就已经可以检测到携带驱动突变的细胞克隆。这个过程就像一场“细胞间的进化竞赛”,不同的患者,甚至同一患者在不同时期,其主导的癌细胞克隆和突变谱都可能完全不同。这种动态演化和异质性,是导致ATL治疗困难和容易复发的重要原因。
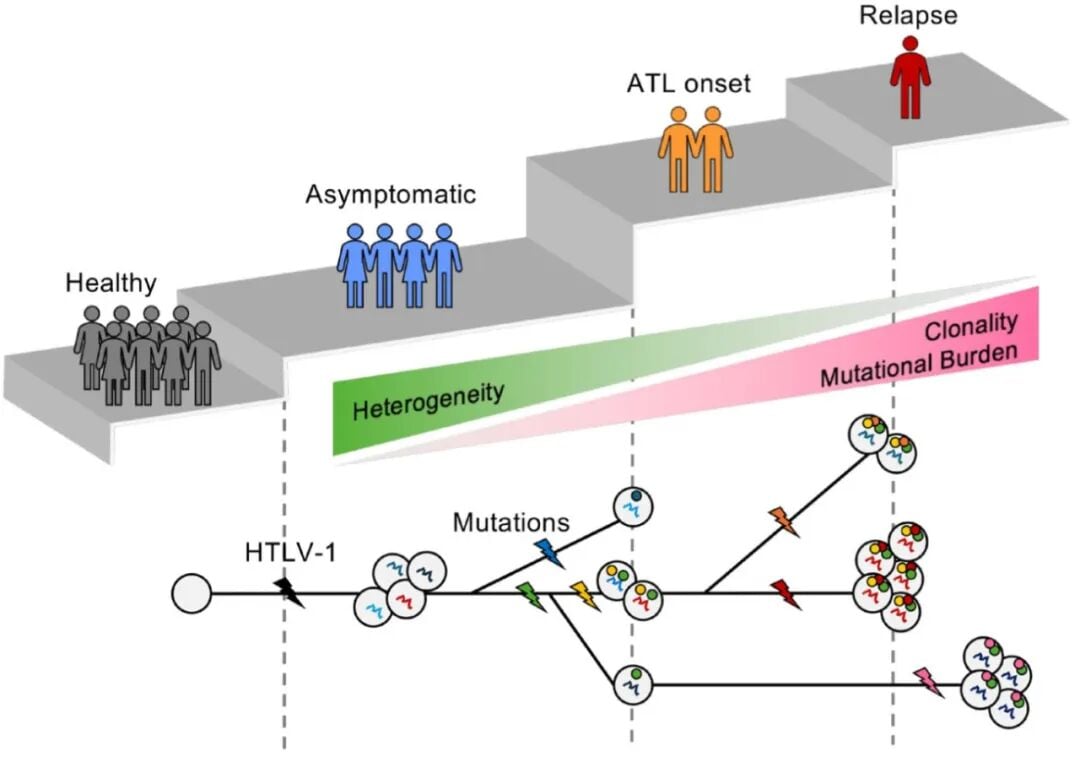
图2. ATL的克隆嵌合体和转化轨迹
基于基因异常的预后评估新模型
准确判断患者的预后,对于制定个体化的治疗方案至关重要。传统的预后因素主要依赖临床指标,如年龄、体能状态、乳酸脱氢酶(LDH)水平等。然而,随着基因组学研究的深入,越来越多的分子标志物被发现与ATL的预后密切相关。
例如,研究表明,PRKCB突变和PD-L1扩增是侵袭性ATL的不良预后因素,而STAT3突变则与较好的预后相关。对于惰性ATL,IRF4突变、PD-L1扩增和CDKN2A缺失则预示着更短的生存期。
基于这些发现,研究人员开发了名为m7-ATL-PI的临床遗传风险模型。该模型巧妙地将传统的临床预后指数(ATL-PI)与七个关键基因(TP53, IRF4, RHOA, PRKCB, CARD11, CCR7, GATA3)的突变状态相结合,能够比传统模型更精准地对患者进行风险分层。这种精准的风险评估,未来可能指导医生为不同风险的患者选择最合适的治疗策略,例如,高风险患者可能需要更积极的治疗方案。
面对复杂的基因检测报告和治疗选择,许多患者和家属常常感到困惑。MedFind的AI问诊服务可以为您提供专业的解读和个性化的建议,帮助您更好地理解病情和治疗方案。
从基因图谱到临床应用:ATL治疗新方向
对ATL基因组学的深入理解,不仅仅是为了预测预后,更重要的是为临床治疗提供了新的思路和靶点。
- 分子分型指导治疗:未来的ATL分类可能不再仅仅局限于传统的临床分型(冒烟型、慢性型、淋巴瘤型、急性型),而是会整合基因组信息,进行更精细的分子分型。就像肺癌根据EGFR、ALK等突变进行分类一样,不同分子分型的ATL患者可能对不同的靶向药物或免疫疗法有不同的反应。
- 高危携带者早期干预:通过监测HTLV-1携带者体内的病毒载量、克隆性以及特定驱动突变的出现,未来有望建立精准的疾病风险预测模型,筛选出最高危的人群。这为开展预防性干预提供了可能,从而在疾病发生前进行阻断。
- 精准靶向治疗:ATL中频繁出现的信号通路异常和免疫逃逸机制,为靶向治疗和免疫治疗提供了丰富的潜在靶点。例如,针对CCR4突变的患者,评估Mogamulizumab的疗效;针对EZH2突变的患者,研究Valemetostat的耐药机制。这些基于生物标志物的研究将推动ATL进入精准医疗时代。
HTLV-1如何通过“表观遗传”启动癌变?
如果说基因组是细胞的“硬件”,那么表观基因组就是调控硬件如何运行的“软件”。ATL的发生,同样离不开表观遗传层面的广泛重塑。HTLV-1病毒及其蛋白,会大规模地改变细胞的表观遗传状态,例如通过H3K27me3修饰和CpG岛高甲基化,来关闭大量肿瘤抑制基因的表达,同时强化那些促进生存和增殖的通路。
这种“表观遗传记忆”非常顽固,即使在疾病晚期,病毒自身表达已经很低,这些被篡改的表观遗传状态依然存在,持续驱动着疾病进展。这为表观遗传靶向治疗提供了理论基础。
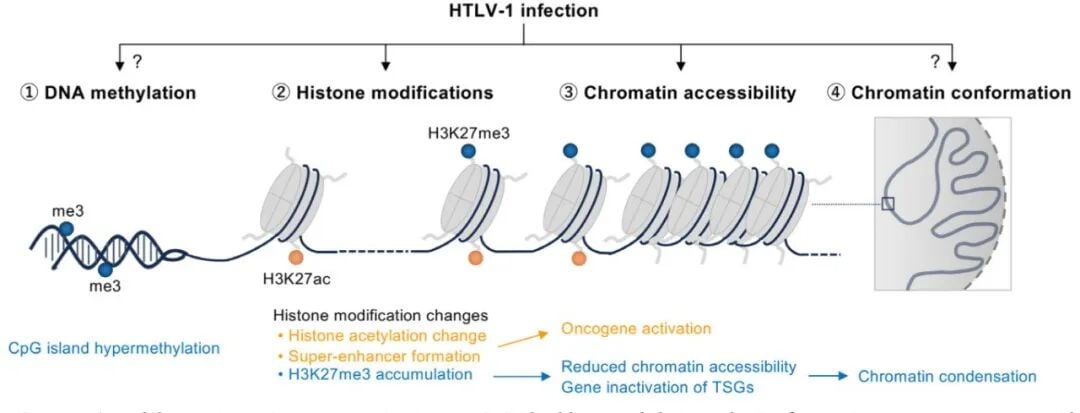
图3. ATL的多层表观基因组重编程机制
靶向治疗新希望:Valemetostat与GARP-TGF-β轴
靶向表观遗传:Valemetostat的临床突破
Valemetostat是一种首创的EZH1/2双重抑制剂,它能够有效逆转ATL细胞中异常的H3K27me3修饰,重新激活被抑制的肿瘤抑制基因。在一项针对复发/难治性侵袭性ATL的II期临床研究中,Valemetostat展现了令人鼓舞的疗效,客观缓解率(ORR)达到了48%,其中完全缓解(CR)率为20%。基于此优异数据,该药已于2022年在日本获批上市,为ATL患者带来了新的治疗选择。
当然,任何药物都存在副作用和耐药问题。Valemetostat的主要不良反应是可管理的骨髓抑制(如血小板减少和贫血)。长期的治疗也可能出现耐药,其机制可能与PRC2复合物的突变或DNA甲基化模式的改变有关。了解这些信息对于患者和医生制定最佳治疗策略至关重要。对于寻求最新治疗方案的患者,了解这些前沿药物的获取渠道、价格及副作用信息至关重要。MedFind致力于为全球癌症患者提供便捷的药品代购服务,确保您能及时获得所需的治疗。
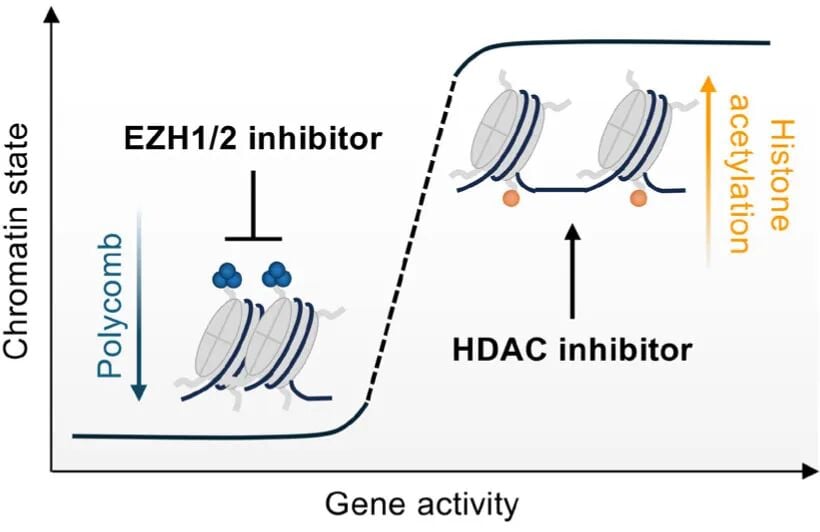
图4. 药物对染色质活性的可调控性
转录组学发现新靶点:GARP-TGF-β轴
除了基因和表观遗传,转录组分析(研究基因如何被表达)也为寻找新靶点提供了线索。研究发现,ATL细胞表面异常高表达一种名为GARP的蛋白,它能激活TGF-β信号通路。这个通路一方面会抑制周围正常免疫细胞的功能,为肿瘤创造一个“免疫抑制”的微环境;另一方面又能促进ATL细胞自身的增殖。
因此,靶向GARP可能起到“一石二鸟”的效果:既能直接杀伤肿瘤细胞,又能解除免疫抑制,激活患者自身的抗肿瘤免疫力。临床前研究已经证实,靶向GARP的抗体依赖性细胞介导的细胞毒性(ADCC)抗体能有效清除ATL细胞。这为开发新型抗体疗法提供了极具前景的方向,有望继Mogamulizumab(靶向CCR4)和维布妥昔单抗(Brentuximab Vedotin,靶向CD30)之后,成为ATL抗体治疗的又一利器。
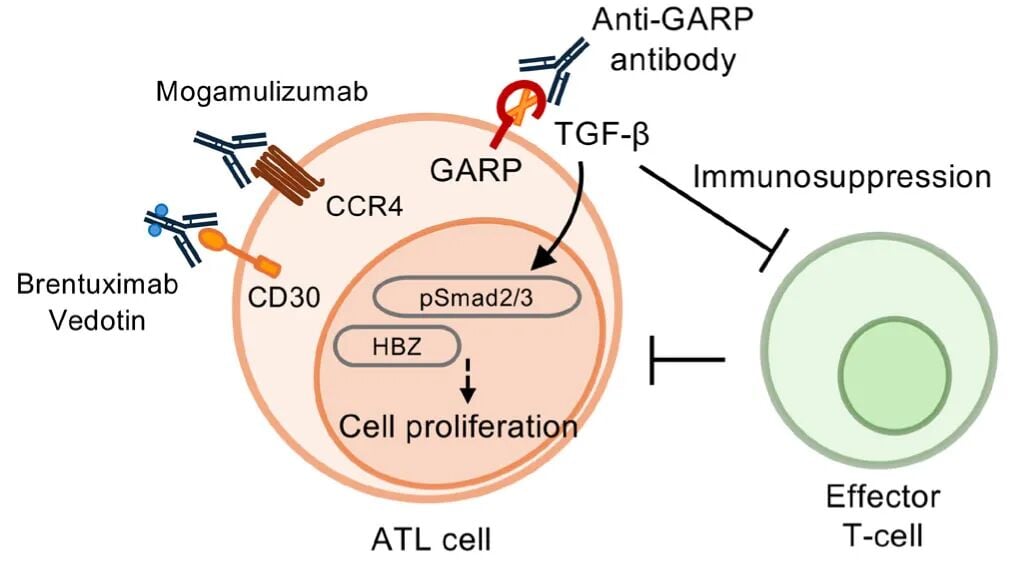
图5. ATL的抗体治疗策略:GARP–TGF-β轴
总结与展望:ATL精准治疗的未来
对成人T细胞白血病/淋巴瘤(ATL)分子机制的深入探索,正以前所未有的速度推动着治疗策略的革新。我们现在知道,ATL是一种由病毒感染启动,历经数十年基因组和表观基因组异常累积而成的复杂疾病。其高度的异质性和动态演化特性是治疗的主要挑战。
未来,整合基因组、表观基因组和转录组等多组学数据的分析方法,将成为实现ATL精准医疗的关键。这不仅能帮助我们更准确地进行风险预测和预后评估,还能为每位患者量身定制最有效的治疗方案,无论是选择合适的靶向药物、免疫疗法,还是设计创新的联合治疗策略。
从Valemetostat的成功上市到抗GARP抗体的巨大潜力,我们看到了攻克这一难治性疾病的曙光。随着研究的不断深入,我们有理由相信,未来将有更多高效、低毒的创新疗法问世,为全球ATL患者带来更长的生存期和更好的生活质量。更多关于ATL及其他癌症的最新资讯,欢迎访问MedFind抗癌资讯板块,与我们一同关注抗癌前沿动态。





