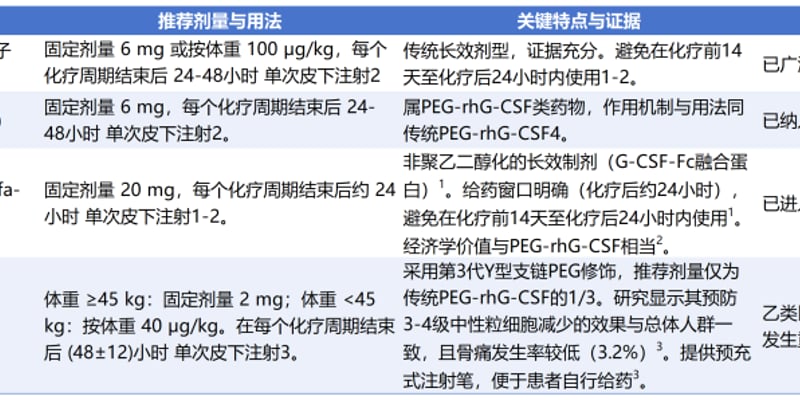
结直肠癌(CRC)是全球常见的恶性肿瘤之一,早期发现和治疗对其预后至关重要。近日,Guardant Health公司研发的Shield血液检测迎来重大里程碑,获得美国食品药品监督管理局(FDA)的全面批准,成为首个获批用于结直肠癌初筛的血液检测方法。这一突破性进展为45岁及以上、处于平均风险的成年人提供了便捷、高效的筛查新选择,有望显著提升结直肠癌的早期诊断率。
核心优势:高灵敏度与特异性
Shield血液检测的临床表现令人瞩目。在ECLIPSE研究(NCT04136002)的扩展队列中,该检测对结直肠癌的检测灵敏度高达84%,特异性达到90%。尤其值得关注的是,其对I期结直肠癌的灵敏度也达到了62%,这意味着即使在疾病早期阶段,Shield也能有效捕捉到癌变信号。Guardant Health的联合首席执行官AmirAli Talasaz表示,新算法在检测I期结直肠癌方面的表现令人满意,再次证明了Shield在同类产品中的领先地位,公司将持续创新,进一步提升其性能。
FDA批准与指南更新:里程碑意义
2024年7月,FDA正式批准Shield血液检测用于45岁及以上、平均风险成年人的结直肠癌筛查。这一决定不仅使其成为首个获得FDA批准作为结直肠癌初筛选项的血液检测,也使其符合了美国医疗保险(Medicare)的报销要求,极大地拓宽了其可及性。马萨诸塞州总医院胃肠病学家Daniel Chung博士指出,现有的结直肠癌筛查方法未能吸引数百万民众,Shield血液检测的获批是巨大的飞跃,将有助于弥补这一筛查缺口,开启血液检测和结直肠癌筛查的新时代,挽救更多生命。紧随其后,2025年6月,美国国家综合癌症网络(NCCN)也更新了其结直肠癌筛查指南,将Shield作为首个FDA批准的血液检测纳入初筛推荐范围。对于确诊癌症的患者,获取海外前沿靶向药至关重要。MedFind致力于为全球癌症患者提供海外靶向药代购服务,确保患者能及时用上所需药物。
ECLIPSE研究:坚实的数据支持
Shield血液检测的监管批准,得益于ECLIPSE这项非随机、前瞻性、多中心注册研究的有力支持。该研究评估了Shield在超过20,000名平均风险结直肠癌患者中的表现,这些患者均计划接受筛查性结肠镜检查。研究要求参与者年龄在45至84岁之间,并同意在结肠镜检查前进行采血。ECLIPSE研究的初步结果已发表在《新英格兰医学杂志》上,数据显示Shield对I期、II期、III期和IV期结直肠癌的灵敏度分别为62%、100%、96%和100%。此外,对晚期腺瘤的检测灵敏度为13%。在临床验证队列中,Shield的总体结直肠癌灵敏度为83.1%,I至III期疾病的灵敏度为87.5%。对于未通过结肠镜检查发现结直肠癌或晚期癌前病变的患者,任何晚期肿瘤的特异性为89.6%。除了药物信息,MedFind还提供全面的抗癌资讯,包括药物信息、诊疗指南等,帮助患者及其家属做出明智的治疗选择。
未来展望:提升筛查可及性
Guardant Health预计,随着美国癌症协会(American Cancer Society)和美国预防服务工作组(United States Preventive Services Task Force)等组织未来将其纳入指南,符合条件的患者的商业保险覆盖范围将持续扩大。Shield血液检测的出现,不仅为结直肠癌筛查带来了革命性的变革,更重要的是,它提供了一个更易于接受的筛查方式,有望显著提高依从性,从而实现更多早期癌症的发现,最终挽救更多生命。在抗癌的道路上,患者不仅需要先进的诊断技术,更需要专业的医疗支持和药物获取渠道。MedFind提供AI问诊服务,为患者提供个性化建议,助力患者战胜病魔。