刚刚闭幕的世界肺癌大会(WCLC)是国际上肺癌领域内最负盛名的学术会议之一,每年都聚集了肺癌领域的重磅研究进展。作为全球首个且唯一具有全面骨髓保护功效、减少化疗导致的骨髓抑制(CIM)疗法,先声药业引进开发的CDK4/6抑制剂曲拉西利(Trilaciclib)也亮相本届WCLC,公布了详细的中国临床数据。

结果显示,在中国肿瘤患者化疗前使用曲拉西利初步骨髓保护作用与境外研究结果相当,能够全面降低化疗引起的骨髓抑制的发生率,可以提高中国广泛期小细胞肺癌患者对化疗的耐受性。
一个月前(7月13日),国家药品监管理局(NMPA)刚刚批准曲拉西利在接受含铂类药物联合依托泊苷方案的广泛期小细胞肺癌(ES-SCLC)患者中预防性使用,以降低化疗引起的骨髓抑制的发生率,曲拉西利也由此成为中国首个上市的骨髓保护预防性药物。伴随着中国患者数据的公布,曲拉西利的“中国面纱”正式揭开。
曲拉西利为何选择差异化开发这样的适应症?临床价值究竟如何?
骨髓抑制:肿瘤临床基石疗法拦路虎,患者生存绊脚石
癌症是全球第二大死因,也是中国的主要公共卫生问题。据WHO和国家肿瘤中心数据显示[1],2020年中国癌症新发病例已经超过450万例,肺癌发病例和致死率均居于首位,分别为81.5万和71.4万例。其中,非小细胞肺癌(NSCLC)约占85%,小细胞肺癌(SCLC)约占15%,尤其SCLC受恶性程度高、易转移、治疗手段相对匮乏导致预后较差。
对于肺癌的临床治疗,该领域权威专家、同济大学附属上海市肺科医院周彩存教授接受医药魔方采访时讲到:“化疗的治疗地位不容忽视,化疗、放疗和外科手术被誉为是抗肿瘤治疗的“三大法宝”。除了极早期患者可以通过手术治愈外,对于绝大数肺癌患者都会使用到化疗治疗,包括新辅助化疗、辅助化疗或者晚期的姑息化疗等,甚至放化疗的同步治疗。从化疗涵盖的治疗线程考虑,约2/3的肺癌患者会使用到化疗。”
然而,作为基础治疗手段的化疗,却又常引起骨髓抑制的副作用,对患者生活质量和生存长度造成多种影响,如中性粒细胞减少会导致身体抵抗疾病的能力下降,出现发热和寒颤、腹泻和皮疹等常见的继发症,也会使患者容易发生感染并可能发展为发热性中性粒细胞减少症(FN),而这种情况有时是致命的需要住院治疗。血小板减少症容易导致出血风险的增加,包括血尿或血便等。化疗诱导的骨髓抑制可谓是患者生活质量和生存长度的绊脚石。
临床治疗中,会对骨髓抑制进行“补救”性治疗,包括采用粒细胞集落刺激因子 (G-CSF)、红细胞生成刺激剂 (ESAs) 、红细胞生成素(EPO)或红细胞
(RBC)
和/或血小板的输注等。但是,这些支持性护理干预通常是应对不良事件的管理,也会基于治疗存在继续诱发不良反应风险,如G-CSF引起的骨痛和肿瘤进展、ESAs引起的高血压、血栓和肿瘤进展以及潜在的输血反应和输血感染等。
需要注意的是,补救性治疗不仅直接增加肿瘤患者的经济负担,严重的更会影响患者的治疗效果。
一项研究报告显示,94%的发热性中性粒细胞减少症急诊需住院。在美国[2],成人因癌症相关的中性粒细胞减少症住院的年度总费用估计约为23亿美元;每位患者每年的贫血管理费用从2.2万美元到
9.4万美元不等;血小板减少症管理的成本估计从每个周期 1395
美元已经增加到2.3万美元。在中国[3],上海交通大学附属胸科医院一项研究显示,该院肺癌患者人均化疗4.5次,发生I~Ⅳ骨髓抑制比例分别为19.13%、21.21%、12.88%、4.05%,每次住院为处理I~Ⅳ度骨髓抑制而花费的成本为1090元、3616元、9859元和13203元,占整个化疗直接卫生成本的8.43%、18.37%、40.09%和46.62%
。这意味着,发生III-IV度骨髓抑制时,患者付出的治疗费用中有四成以上并不是用于直接抗癌,而是用于处理化疗引起的毒副作用。
然而,补救性的措施有时并不会立即起效。即便生效,对于出现了严重骨髓抑制的患者,往往也必须降低化疗剂量;对于无法控制的严重骨髓抑制,只能延迟给药或治疗中断来进行管理,造成治疗延误。毫无疑问,这类措施会直接影响肿瘤患者的临床治疗效果,导致生存期的缩短。
曲拉西利:创新药差异化临床开发典范
CDK4/6是一种调节细胞周期的关键因子,协同cyclin D1蛋白一起调节细胞周期。由于雌激素受体(HR)会调节cyclin
D1的转录,CDK4/6也就作为HR+/HER2-乳腺癌的治疗靶点进行药物开发,可以克服或延迟内分泌疗法抵抗的出现,延长这类乳腺癌患者的生存期。曲拉西利不走寻常路,是目前为止全球唯一一款开发用于减少化疗导致的骨髓抑制并且在该适应症上获得成功上市的CDK4/6抑制剂。
曲拉西利作为一款高效、选择性的CDK4/6抑制剂,在化疗前预防性给药,可诱导骨髓造血干/祖细胞暂时停滞在细胞周期的G1期,从而减少了暴露于化疗中造成的损伤。
在相同的机制下,为什么其他CDK4/6抑制剂不选择开发这个适应症呢?
先声药业肿瘤领域首席医学官Bijoyesh
Mookerjee博士指出,目前用于乳腺癌的CDK4/6口服抑制剂如哌柏西利、阿贝西利和利柏西利等具有的较长半衰期也会让肿瘤细胞受到保护,让化疗的抗癌作用失效,从而无法实现与短效静脉化疗药物的联合使用。而曲拉西利和上述同靶点药物的显著差异就是具有较短的半衰期优势(约5小时),可以在化疗前静脉给药预防化疗诱导的骨髓抑制。
此外,与临床上各类长短效G-CSF单纯提高白细胞数量、不能避免血小板与红细胞降低风险有所不同,曲拉西利在保护骨髓中性粒细胞的同时,还能减低化疗对于血红蛋白以及血小板的损伤。
同济大学附属上海市肺科医院周彩存教授继续指出:临床上,肿瘤治疗相关毒副作用的应对“防重于治”。曲拉西利相对于G-CSF、EPO等最大的优势是用于化疗前,能够同时保护红系、粒系、巨核系等多个造血谱系,当化疗作用结束后,这些细胞又能恢复正常的造血功能。目前所使用的G-CSF、EPO等药物,与曲拉西利机制上存在差异,不能实现提前预防性保护,化疗对骨髓细胞也会杀伤,尤其长时间化疗后,患者的骨髓储备功能更差。此时,使用的G-CSF、EPO等药物又是加速细胞分化、促进细胞成熟,而化疗已经让这些细胞功能受损,强行调动只会让患者出现疼痛等不舒服的用药体验。
曲拉西利3项(G1T28-05、G1T28-02、G1T28-03)随机双盲、安慰剂对照的临床试验也证明,曲拉西利能够显著改善严重中性粒细胞减少发生率及持续时间,降低3/4级贫血及血小板减少症发生率、化疗剂量降低发生率、粒细胞集落刺激因子(G-CSF)给药发生率及第5周起红细胞输注发生率,且在骨髓抑制和血细胞减少引起的并发症如严重感染等多项临床及实验室指标上都取得了相当程度的改善。
2022年在美国临床肿瘤学年会(ASCO)上,这3项研究的事后分析数据再次表明[4],与安慰剂相比,无论是一线治疗还是二线及以上治疗,接受曲拉西利的患者均较少发生严重中性粒细胞减少症(SN)、贫血(SA)和血小板减少症(ST)的骨髓抑制事件。

今年2月,曲拉西利中国III期关键性注册临床试验(TRACES研究)也宣布达到主要研究终点,如今亮相WCLC,也算是实至名归。
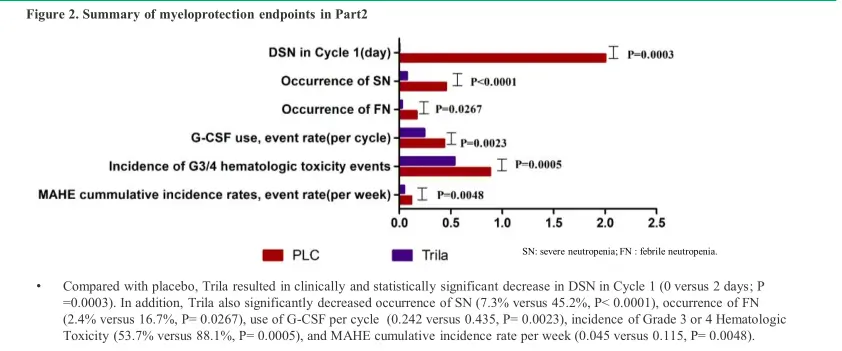
具体来说[5],至数据截止日期(2021年12月29日),在中国患者化疗前给予曲拉西利可显著缩短第1周期严重中性粒细胞减少持续时间(0 vs 2天;
P=0.0003)。此外,曲拉西利还显著降低严重中性粒细胞减少(SN)的发生率 (7.3% vs 45.2%,P <
0.0001)、发热性中性粒细胞降低(FN)的发生率 (2.4% vs 16.7%,P=0.0267)以及3/4级血液学毒性的发生率 (53.7% vs
88.1%,P=0.0005)。
安全性上,使用曲拉西利(Trila)的患者中,除了高甘油三酯血症和γ-谷氨酰转移酶略有升高外,其他所有TEAE均低于安慰剂对照(PLC)。与PLC相比,使用Trila
的≥3 级不良事件发生更少(61% vs 88.1%),这主要是由于≥3 级血液学AE(53.7% vs 88.1%)事件发生更低。

针对临床研究结果,曲拉西利中国小细胞肺癌III期临床参与专家之一、河南省肿瘤医院内科副主任王启鸣教授强调,使用曲拉西利的患者能够保持良好的骨髓状态,从而保证了按时足量开展下一周期治疗。同时,曲拉西利与化疗联合使用不会对化疗产生干扰,不会影响化疗药物治疗SCLC的效果。
商业化前景:曲拉西利值得期待
有报道称[6],2022年全球化疗诱导骨髓抑制的市场规模约为80.6亿美元,预计在预测期内将以3.3%的复合年增长率增长,到2028年达到97.8亿美元。其中,化疗引起的中性粒细胞减少症(CIN)预防规模预计将在2022年达到50亿美元左右,占化疗诱导骨髓抑制治疗市场的61.6%。
根据《柳叶刀》数据推算[7],目前我国年新发需要化疗的瘤种患者数达280万人,到2040年将继续快速增长至420万人,而80%的化疗药可能导致骨髓抑制的发生。加之,癌症的早期诊断、认识提高、工业增长、老年人口、可支配收入的增加以及医保谈判促使的先进肿瘤治疗方案的可及性等诸多因素,也推动了化疗、放疗和免疫联合疗法等治疗手段的普世性,反过来也会成为化疗诱导的骨髓抑制治疗市场的主要驱动力。受未满足的临床需求和潜在的庞大患者群体等因素影响,可以预见中国化疗诱导的骨髓抑制治疗产品和服务市场也将呈现高速增长。
化疗是肿瘤治疗上的重要基石,即使伴随着靶向治疗和免疫治疗在不同瘤种上的普及,化疗会有治疗线级的改变,但极少完全退出肿瘤患者的终身治疗选择。因此,化疗依然拥有最广泛的潜在治疗群体,特别是占肺癌约15%的小细胞肺癌领域,化疗更是完全涵盖了早期的辅助治疗、初治治疗(一线治疗)、维持治疗以及后期的二线治疗等,即便是最先进的免疫疗法依旧需要联合化疗开展治疗。
或许,这也是曲拉西利选择小细胞肺癌作为首发适应症的原因之一。作为最严重的血液学毒性,全球每年大约有240万个化疗周期存在中等风险到高风险的CIN。而化疗引起的血小板减少减少症
(CIT),相对于CIN可选择治疗更加有限。曲拉西利基于优异的临床数据,2019年被FDA授予小细胞肺癌的突破性药物资格(BTD),2021年2月通过优先审评快速上市,成为全球首个且唯一具有全面骨髓保护功效的CDK4/6抑制剂药物。
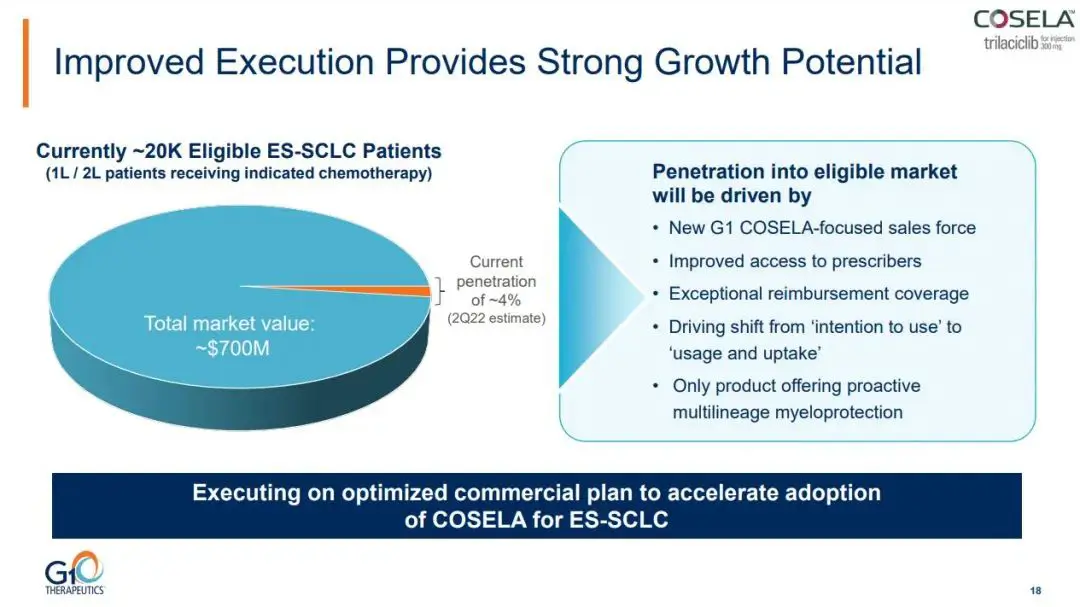
曲拉西利另辟新径的战略决策避开了CDK4/6同类药物的残酷竞争,在骨髓抑制保护领域开辟了新的天地。在广泛期小细胞肺癌领域,骨髓抑制保护市场规模也有7亿美元,而曲拉西利已经开始发力,目前估算的年化渗透率约为
4%(2Q22)。
曲拉西利预防骨髓抑制的临床价值也不会仅局限于小细胞肺癌领域。在适应症的拓展策略上,先声药业首席医学官Bijoyesh
Mookerjee博士认为,需要充分利用曲拉西利的差异化优势,选择对化疗敏感而对CDK4/6抑制剂不敏感的瘤种,在这些领域短效可逆CDK4/6抑制剂可以充分发挥作用。
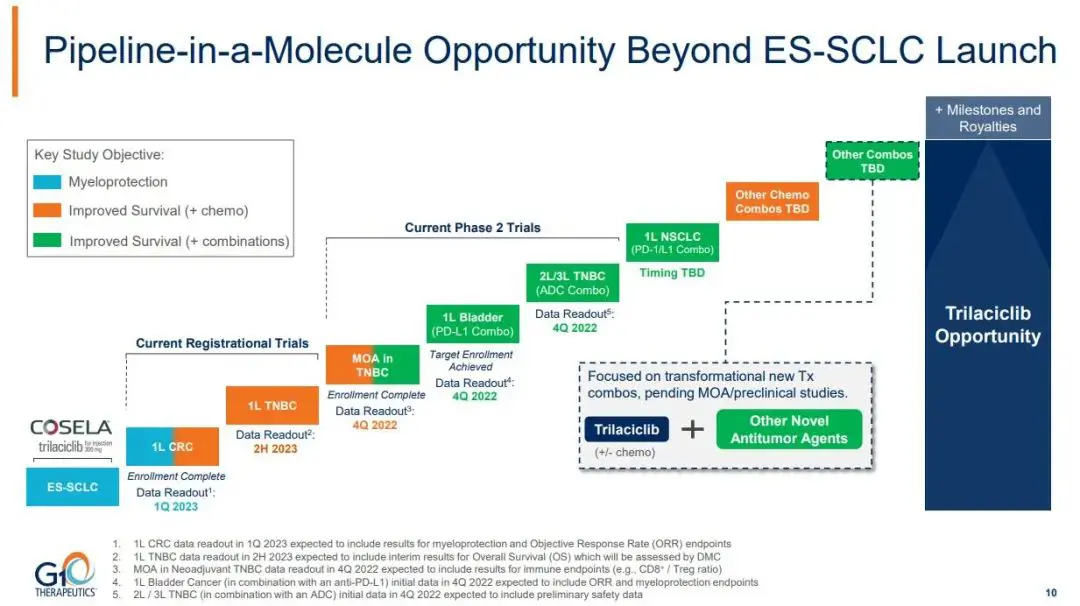
因此,曲拉西利先后在结直肠癌、三阴性乳腺癌、非小细胞肺癌、膀胱癌等肿瘤中开展了骨髓抑制治疗的临床研究。而先声药业在与G1
Therapeutics达成1.7亿美元的独家许可协议之后,也快速在国内展开了针对广泛期小细胞肺癌、转移性结直肠癌、三阴性乳腺癌的三项注册临床试验,紧追全球适应症拓展步伐。其中,结直肠癌和三阴性乳腺癌也已经达到了临床注册阶段,并且在三阴性乳腺癌的临床II期研究中,显示了延长患者总生存期(17.8m
vs 12.6m)的临床优势。
结语
从首例小细胞肺癌患者入组到公布III期研究获得阳性结果仅用时约10个月,上市申请也获得中国药监局优先审评审批资格,实现了在美国上市仅一年后,便在中国获批,彰显了先声药业的创新药开发速度。更重要的是,曲拉西利的获批上市,填补了国内临床治疗上没有预防性骨髓保护药物的空白,有望降低患者化疗后多次开展血液理化检测的身体负担,在减轻肿瘤患者重骨髓抑制不良事件治疗负担的同时,能够让患者更好的从化疗治疗中受益,提高患者的生存质量和长度。
可以说,曲拉西利的上市,完美的演绎了抗肿瘤药物以临床价值为导向的开发思路。此外,曲拉西利获批骨髓保护适应症,与同类CDK4/6抑制剂的差异化适应症,也避免了更激烈的竞争。可以预见,对于临床空白的治疗领域,曲拉西利也会有不一样的商业表现。
参考资料:
[1]
https://gco.iarc.fr/today/data/factsheets/populations/160-china-fact-sheets.pdf;Cancer
incidence and mortality in China, 2016.
https://doi.org/10.1016/j.jncc.2022.02.002
[2] Tai E, Guy GP, Dunbar A,Richardson LC. Cost of cancer-relatedneutropenia
or fever hospitalizations,United States, 2012. J Oncol
Pract.2017;13(6):e552-61.
[3] 王晓辉, 朱 珺, 赵 东. 肺癌化疗不良反应的经济学研究[J].上 海 交 通 大 学 学 报 ( 医 学 版 ) Vol. 32 No. 5
May 2012 32(5): 657-659.
[4] Impact of trilaciclib on multilineage chemotherapy-induced
myelosuppression events in patients with extensive-stage small cell lung cancer:
Post-hoc analyses of data from randomized clinical trials. 2022 ASCO:Abstract
8568
[5] Myeloprotection with Trilaciclib in Chinese Patients with Extensive-Stage
Small Cell Lung Cancer Receiving Standard Chemotherapy (TRACES). 2022 WCLC:
EP08.02-078
[6] Chemotherapy-Induced Myelosuppression Treatment Market Outlook
(2022-2028).Future Market
Insight.https://www.futuremarketinsights.com/reports/chemotherapy-induced-myelosuppression-treatment-market;http://www.myelotherapeutics.com/chemotherapy.html
[7] Brooke E Wilson, Susannah Jacob, Mei Ling Yap, et al. Estimates of global
chemotherapy demands and corresponding physician workforce requirements for 2018
and 2040: a population-based study.Lancet Oncol.May 08, 2019