当癌症来袭,患者和家属最担心的莫过于治疗效果不佳或出现耐药。尤其是对于存在基因突变的癌症,如携带BRCA1突变的乳腺癌和卵巢癌,虽然初期对特定靶向药(如PARP抑制剂)反应良好,但耐药性常常成为一道难以逾越的障碍。最近,《Science》杂志上发布的一项重磅研究,为我们揭示了癌症耐药背后一个至关重要的“分子开关”——CST复合体。这项发现不仅深入剖析了DNA修复机制的奥秘,更指明了未来克服癌症耐药、为患者提供精准治疗的新方向。MedFind致力于将这些前沿医学突破转化为患者能够理解并受益的信息,帮助大家更好地了解疾病与治疗方案,获取全球优质抗癌资源。
癌症治疗的挑战:DNA损伤与耐药性
我们身体的每一个细胞都包含着至关重要的遗传物质——DNA,它就像一本记录生命指令的百科全书。然而,这本“书”在日常生活中会不断受到各种内外因素的损伤,比如环境中的化学物质、辐射,甚至是细胞自身代谢产生的“垃圾”。为了维持生命指令的完整性,细胞内配备了一套精密的“DNA修复系统”,能及时修补这些损伤。然而,癌细胞却非常狡猾,它们常常利用或改造这个修复系统,为自己的无限增殖和逃避治疗提供便利。当DNA损伤无法被有效修复时,细胞可能会走向死亡,但这恰恰是癌症治疗希望达到的效果。许多化疗药物和靶向药物,其作用原理就是制造或加剧癌细胞的DNA损伤,使其不堪重负而凋亡。
不幸的是,癌细胞在长期治疗过程中,往往会发展出“耐药性”,这意味着它们能够适应并抵抗药物的攻击,导致治疗失败。理解癌细胞如何实现耐药,特别是它们如何改造DNA修复途径来规避药物的杀伤,是当前癌症研究的重中之重。尤其对于像乳腺癌和卵巢癌这样的常见癌症类型,耐药问题严重限制了患者的长期生存。
DNA修复的“双通道”:非同源末端连接(NHEJ)与同源重组(HR)
在所有DNA损伤中,双链断裂(DSBs)是最严重的一种,它就像是生命之书被撕成了两半。如果不能正确修复,可能导致染色体结构错乱,这是癌症的一个显著特征。细胞主要通过两种核心机制来修复DNA双链断裂:
- 非同源末端连接(NHEJ):这种方式相对“粗糙”,它会直接将断裂的DNA两端简单地连接起来,不依赖于任何模板。虽然速度快,但容易引入小的基因缺失或插入,导致错误。想象一下,就像是匆忙地将两根断了的绳子随便打个结。
- 同源重组(HR):这是一种“精准”的修复方式。它会利用同源染色体(另一条完整的染色体)作为模板,来精确地复制并修补断裂的DNA。这种方式准确率高,但要求细胞处于特定的分裂周期,且依赖于一系列复杂的蛋白质,其中BRCA1基因编码的蛋白质就是关键的“指挥官”之一。就像是严格按照设计图纸,精心地修复受损的部件。
我们的细胞会根据损伤的类型、细胞所处的状态以及特定基因(如BRCA1、53BP1等)的功能,来决定选择哪种修复途径。如果BRCA1基因发生突变,就像是失去了那位精准的“指挥官”,细胞的同源重组能力就会大大受损,不得不更多地依赖错误率更高的非同源末端连接,这也就解释了为什么BRCA1突变与家族性乳腺癌和卵巢癌的风险显著相关。
PARP抑制剂与BRCA1缺陷型肿瘤:希望与困境
正是基于对DNA修复机制的深入理解,科学家们开发出了一类被称为PARP抑制剂的靶向药物,为携带BRCA1或BRCA2基因突变的癌症患者带来了巨大的希望。这类药物通过“合成致死”的原理发挥作用:
- **PARP**是一种修复DNA单链损伤的酶。PARP抑制剂会阻止PARP发挥作用,导致DNA单链损伤累积,进而发展成更严重的双链断裂。
- 正常细胞拥有完整的同源重组(HR)修复系统,能够有效修复这些双链断裂,所以受到的影响较小。
- 然而,对于BRCA1或BRCA2突变的癌细胞,它们的同源重组修复功能本身就存在缺陷。当PARP抑制剂进一步制造大量双链断裂时,癌细胞的修复系统将不堪重负,最终走向死亡。
这类药物,例如奥拉帕利(点击查看购买渠道与价格)和尼拉帕利(点击查看购买渠道与价格),在治疗BRCA1突变相关的卵巢癌、乳腺癌等多种癌症中取得了显著疗效。但遗憾的是,许多患者在接受治疗一段时间后,癌细胞会再次找到“逃生通道”,对PARP抑制剂产生耐药性,这让患者和医生都面临巨大的挑战。
重磅发现:CST复合体——DNA修复的“分子开关”
理解PARP抑制剂耐药的机制,对于开发新的治疗策略至关重要。得克萨斯大学圣安东尼奥健康科学中心Patrick Sung团队在《Science》杂志上发表的这项研究,就揭示了一个在DNA修复途径选择和PARP抑制剂耐药中扮演关键角色的CST复合体。
CST复合体是由CTC1、STN1和TEN1三种蛋白质组成的异三聚体,它此前被认为是DNA复制和端粒维护的重要因子。这项最新研究发现,CST复合体竟然能够通过多层机制,负向调控DNA末端切除的过程。DNA末端切除是同源重组(HR)修复途径的“启动步骤”,它需要DNA末端被精确地“裁剪”成单链DNA,才能作为后续修复的模板。如果这一步被阻断,HR修复就无法启动,细胞将不得不转向非同源末端连接(NHEJ)修复。
更重要的是,研究发现BRCA1能够“解除”CST复合体介导的DNA末端切除阻滞。这就像是,CST复合体试图将HR修复的“闸门”关闭,而BRCA1则有能力重新打开这扇“闸门”,让HR修复顺利进行。这一发现为理解在缺乏BRCA1的肿瘤中出现的耐药性提供了全新的视角。
作用机制深度解析:CST如何“阻碍”修复?
研究团队深入探究了CST复合体抑制DNA末端切除的具体机制:
- 抑制EXO1酶活性:CST复合体能够直接抑制EXO1(一种重要的5′-3′核酸外切酶)的活性,从而阻碍DNA末端的切除过程。
- 抑制BLM-DNA2复合物:除了EXO1,CST复合体也能对BLM-DNA2解旋酶-核酸酶复合物产生抑制作用。BLM-DNA2同样参与DNA末端切除,它们协同工作,高效裁剪DNA。CST复合体通过不同于EXO1的作用方式来限制BLM-DNA2的功能。
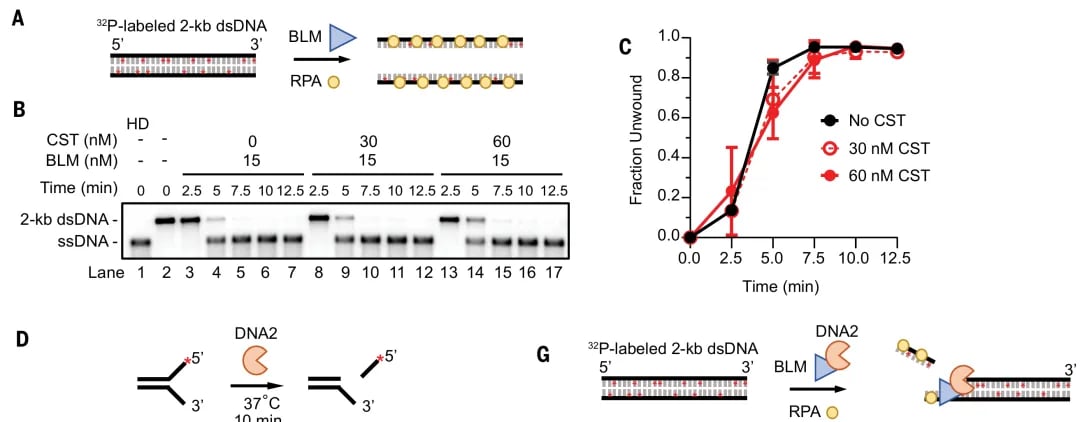
这项研究还发现,BRCA1-BARD1复合物能够解除CST复合体对EXO1的抑制作用,让DNA末端切除得以顺利进行,从而激活同源重组修复。然而,BRCA1-BARD1对CST复合体对BLM-DNA2的抑制作用却几乎没有影响,这说明CST复合体对DNA末端切除的调控是多层次、多靶点的。此外,研究人员发现,如果CST复合体发生突变,导致其DNA结合能力或与BLM-EXO1的相互作用受损,就会导致过度切除的现象,并且会使BRCA1缺陷的细胞对PARP抑制剂产生抵抗性。
CST与癌症耐药:揭示BRCA1缺陷型肿瘤的新靶点
这项研究最重要的临床意义在于,它揭示了CST复合体在决定DNA双链断裂修复途径中扮演的关键角色,并将其与PARP抑制剂耐药机制紧密联系起来。在BRCA1缺陷的肿瘤细胞中,同源重组修复功能受损,使得这些细胞对PARP抑制剂敏感。然而,如果53BP1轴(包括CST复合体在内的调控网络)的功能也发生障碍,可能会恢复一部分DNA末端修复和RAD51载体的加载,从而间接恢复了同源重组的能力。这样一来,癌细胞就可能重新获得修复DNA损伤的能力,对PARP抑制剂产生耐药性。
因此,深入理解CST复合体如何影响DNA修复和PARP抑制剂耐药,为我们提供了全新的思路:
- **理解耐药机制**:这项研究阐明了CST复合体是如何在DNA双链断裂修复途径选择中发挥关键作用,从而影响癌细胞对PARP抑制剂的敏感性,为我们解释了部分PARP抑制剂耐药现象的分子基础。
- **开发新药靶点**:既然CST复合体是决定DNA修复途径的“分子开关”,那么针对CST复合体进行干预,比如开发能够抑制CST复合体功能的药物,或者能够解除其对HR修复抑制的药物,就有可能重新激活PARP抑制剂在耐药患者体内的疗效。这为克服当前PARP抑制剂的耐药困境,提供了令人振奋的新策略。
- **精准治疗探索**:未来,通过检测患者肿瘤细胞中CST复合体的功能状态,或许可以更精准地预测患者对PARP抑制剂的反应,或指导是否需要联合针对CST复合体的治疗,从而实现更个性化的精准医疗。
展望未来:精准医疗的广阔前景
这项关于CST复合体的突破性发现,无疑为乳腺癌、卵巢癌等BRCA1突变相关肿瘤的治疗研究注入了新的活力。它不仅加深了我们对DNA修复复杂网络的理解,更重要的是,为开发克服PARP抑制剂耐药的新型疗法指明了方向。未来,随着对CST复合体及其相关机制研究的不断深入,我们有望开发出更加有效、精准的治疗策略,让更多的癌症患者受益。
对于癌症患者及其家属而言,了解这些前沿的医学研究进展至关重要。MedFind始终关注全球最新的抗癌资讯和治疗突破,并致力于将其以最通俗易懂的方式呈现给大家。我们相信,知识就是力量,它能帮助患者做出更明智的治疗选择,积极面对挑战。MedFind作为专业的抗癌信息共享平台,不仅提供最新的诊疗指南和药物信息,还能为您提供AI辅助问诊服务,并协助构建海外购药渠道,帮助您获取国际前沿的抗癌药品和治疗方案。如果您正面临治疗困境,或者希望了解更多关于PARP抑制剂和耐药性克服的最新进展,欢迎随时访问MedFind平台,获取专业的支持与帮助。





