对于无数癌症患者和家庭而言,每一次医学新发现都如同黑夜中的一盏明灯,带来无尽的希望。近期,中国科学院生物物理研究所丁璟珒、北京生命科学研究院邵峰和周志伟三位科学家,在国际顶级期刊《Immunity》上发表了一项突破性研究,揭示了免疫细胞一种全新的“自杀式”杀癌机制,为肿瘤免疫治疗领域开辟了激动人心的新路径。这项研究聚焦于细胞焦亡——一种特殊的细胞死亡方式,它如何被免疫系统精准操控,并成为我们对抗癌症的有力武器。MedFind作为专注于抗癌新药与治疗资讯的平台,将深入浅出地为您解读这项前沿成果,让您了解它可能为未来癌症治疗带来的变革。
癌症治疗的“希望之光”:免疫细胞如何精准清除肿瘤?
癌症,是威胁人类健康的重大疾病。在与癌症的漫长搏斗中,我们不断探索更有效、更精准的治疗方案。近年来,免疫治疗的崛起为癌症患者带来了革命性的改变,它通过激活患者自身的免疫系统来对抗肿瘤。在我们的免疫大军中,有一群被称为“细胞毒性淋巴细胞”的精锐部队,包括细胞毒性T淋巴细胞和自然杀伤(NK)细胞。它们就像是体内的“特种兵”,负责识别并清除受到感染的细胞或癌细胞。但这些“特种兵”是如何执行“清除任务”的呢?传统的观点认为,它们主要通过诱导靶细胞凋亡(一种程序性细胞死亡)来达到目的。然而,科学家们发现,免疫细胞还掌握着另一种更为激烈、被称为“细胞焦亡”的杀敌方式,而这项最新研究就深入揭示了这种独特机制。
什么是“细胞焦亡”?为什么它对抗癌更具潜力?
要理解这项研究的意义,我们首先要了解“细胞焦亡”这个概念。试想一下,当您的身体遭遇病毒入侵或细胞癌变时,哪些细胞死亡方式更有利于清除威胁呢?
- 细胞凋亡(Apoptosis): 这是一种“安静的死亡”。细胞会内敛地自我瓦解,形成小泡被其他细胞吞噬,不引起炎症。就像是敌军士兵悄悄自尽,不留痕迹。
- 细胞焦亡(Pyroptosis): 这是一种“爆炸性的死亡”。当细胞焦亡发生时,细胞膜上会形成大量孔洞,导致细胞膨胀、破裂,细胞内的物质(包括一些促炎因子)会释放出来,从而引发强烈的炎症反应。这就像是敌军基地被轰炸,不仅敌人被消灭,爆炸声还会引来更多的友军(其他免疫细胞)来支援,共同清除残余威胁。
正因为细胞焦亡具有这种促炎性特点,它在清除病原体和癌细胞方面展现出独特的优势。它不仅能直接杀死癌细胞,释放出的炎症信号还能进一步“唤醒”和“招募”更多的免疫细胞,增强整体的抗肿瘤免疫反应。这对于癌症治疗来说,无疑是一种更强大的武器。
核心执行者:Gasdermin家族蛋白
细胞焦亡的执行者是一类被称为“Gasdermin”(GSDM)家族的蛋白。当这些蛋白被激活并切割后,其中一部分会形成孔洞,导致细胞膜破裂。在这个家族中,最先被发现的是Gasdermin D (GSDMD),它在许多炎症反应中都发挥着关键作用。而这项研究的主角,则是GSDM家族中的另一位重要成员——Gasdermin B (GSDMB)。

免疫细胞的“秘密武器”:颗粒酶A如何激活GSDMB?
既然细胞焦亡如此重要,那么免疫细胞是如何精准地启动它,来对付癌细胞的呢?这项研究的发现,为我们揭示了其中的一个关键秘密:颗粒酶A(Granzyme A,简称GZMA)。
颗粒酶A (GZMA):免疫细胞的“剪刀手”
颗粒酶A是一种由细胞毒性淋巴细胞分泌的蛋白酶,可以理解为一把能剪切特定蛋白质的“剪刀”。过去我们知道,GZMA能够进入靶细胞内部,执行其杀伤任务。但它具体如何识别并切割GSDMB,从而启动焦亡的,一直是一个未解之谜。
研究核心发现:GZMA的“二聚体”结构与“胞外位点”
中国科学院团队的这项研究,正是揭开了这个谜团。他们发现,人类的颗粒酶A拥有一个非常独特的结构——它不是以单个分子(单体)的形式工作,而是以“二聚体”(由两个GZMA分子连接而成)的形式存在。更关键的是,这个二聚体形成了一个特殊的“胞外位点”(可以理解为GZMA表面一个独特的识别区域,与它的活性中心——“剪刀口”——是分开的)。
这项研究通过精密的结构分析(例如晶体结构解析),发现正是这个二聚体形成的“胞外位点”,能够以高亲和力(就像是精准的“锁孔”)识别并牢牢结合GSDMB蛋白的C结构域。这种独特的结合方式,使得GZMA能够精准地将GSDMB在特定位置(Lys244)切割,从而释放出GSDMB的成孔活性,最终导致癌细胞发生焦亡。这就像是一把经过特殊设计的钥匙,不仅有能剪切的“刃”,还有能精准定位“锁孔”的“齿”,确保它只剪切特定的目标。
与小鼠GZMA的对比:揭示人类免疫的精妙之处
有趣的是,研究人员还对比了小鼠的GZMA。他们发现,尽管小鼠GZMA也具有类似的二聚体结构,但由于其“胞外位点”的细微偏差,它在切割GSDMB的效率上远不如人类GZMA。通过结构导向的基因突变,科学家们甚至能让小鼠GZMA变得像人类GZMA一样高效地切割GSDMB。这不仅验证了“胞外位点”在精准识别中的关键作用,也从侧面说明了人类免疫系统在演化过程中,可能发展出了更精妙的杀伤机制。
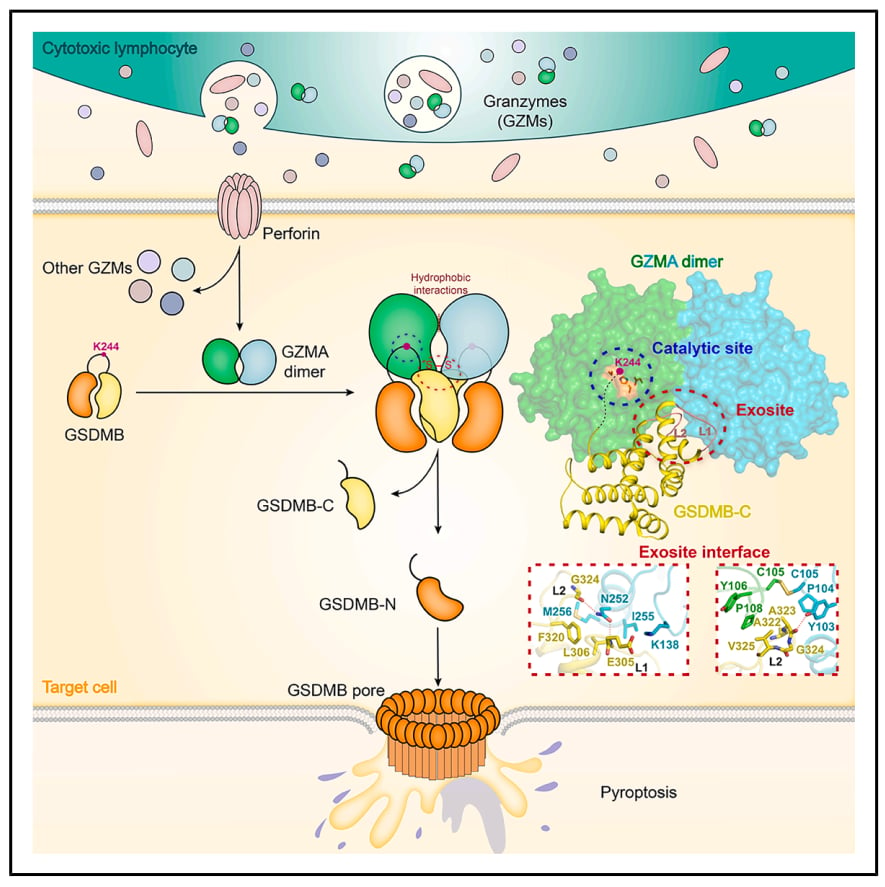
焦亡机制模式图(图源自Immunity)
这项突破性研究对癌症患者意味着什么?——肿瘤免疫治疗的新方向
这项深入揭示GZMA如何特异性靶向GSDMB诱导细胞焦亡的研究,具有里程碑式的意义。它不仅深化了我们对细胞免疫杀伤机制的理解,更重要的是,为未来的癌症治疗,特别是肿瘤免疫治疗,指明了新的方向。
-
1. 增强肿瘤免疫治疗效果
- 目前的免疫治疗,如PD-1/PD-L1抑制剂,已经帮助许多患者取得了前所未有的疗效。但仍有部分患者效果不佳或容易复发。如果能通过药物或基因工程手段,增强免疫细胞分泌GZMA的能力,或者提高癌细胞对GZMA诱导焦亡的敏感性,就有望进一步提升免疫治疗的总体有效率,让更多患者受益。
-
2. 开发新型靶向药物
- 了解了GZMA与GSDMB之间精准的“钥匙-锁孔”机制,科学家们就可以设计出模仿GZMA或其“胞外位点”特点的药物,直接靶向癌细胞内的GSDMB,诱导其发生焦亡。甚至可以开发一些小分子药物,通过增强GZMA的二聚化,或优化其对GSDMB的结合能力,来更有效地启动焦亡过程。这为研发全新的抗癌药物提供了具体的思路和靶点。
-
3. 克服现有治疗的局限性
- 有些癌细胞可能会发展出抵抗凋亡的能力,从而逃避免疫系统的杀伤。而焦亡作为一种不同的细胞死亡途径,可能成为突破这些耐药性的新策略。通过激活焦亡,即使癌细胞对凋亡产生抵抗,也难以逃脱被清除的命运。
-
4. 筛选对焦亡敏感的患者
- 未来,我们甚至可以通过检测患者体内GZMA和GSDMB相关通路的活跃程度,来预测其对焦亡诱导治疗的响应潜力,从而实现更精准的个体化治疗。
MedFind与您共同关注:从实验室到临床,治疗希望在路上
这项发表在《Immunity》上的研究,是基础科学领域的重要突破。它告诉我们,免疫系统对抗癌细胞的智慧远超我们的想象,而我们正一步步揭开这些奥秘。尽管从实验室的发现到真正应用于临床治疗,往往还需要漫长的转化过程,包括大量的临床前研究、临床试验等,但正是这些基础研究,点亮了未来抗癌道路上的希望。
作为癌症患者和家属,我们可能无法直接参与到这些复杂的科学研究中,但我们可以持续关注这些前沿进展。MedFind平台深知每一份希望对您的重要性,我们致力于为您提供最新、最权威的抗癌资讯和药物信息。我们时刻关注全球医学前沿动态,将这些深奥的科学研究成果,以通俗易懂的方式呈现给您,帮助您了解最新的治疗趋势和潜在的治疗方案。
MedFind不仅是抗癌资讯的分享者,更是您获取全球优质抗癌药品的桥梁。我们理解患者在治疗过程中面临的挑战,因此提供抗癌药品代购与国际直邮服务,确保您能及时、便捷地获取所需的药物。同时,我们的AI辅助问诊服务,也能在一定程度上为您提供个性化的治疗建议和信息支持。我们希望通过MedFind的努力,让前沿的医学研究成果,能够更快、更有效地惠及每一位需要的患者。
结语
丁璟珒、邵峰、周志伟等科学家团队的这项研究,无疑为肿瘤免疫治疗领域注入了新的活力。它不仅让我们对免疫细胞杀伤癌细胞的机制有了更深刻的理解,更重要的是,为开发更高效、更精准的抗癌新药指明了方向。对于正在与癌症抗争的患者们,请您坚信,科学的进步永不止步,新的希望正在不断涌现。MedFind将始终与您并肩,共同关注这些带来希望的每一次突破,努力将最前沿的治疗方案带到您的身边,为您的康复之路保驾护航。如果您对文中提及的治疗理念或抗癌药物有进一步的疑问,或希望了解海外购药渠道,欢迎随时通过MedFind平台进行咨询,我们将竭诚为您服务。





