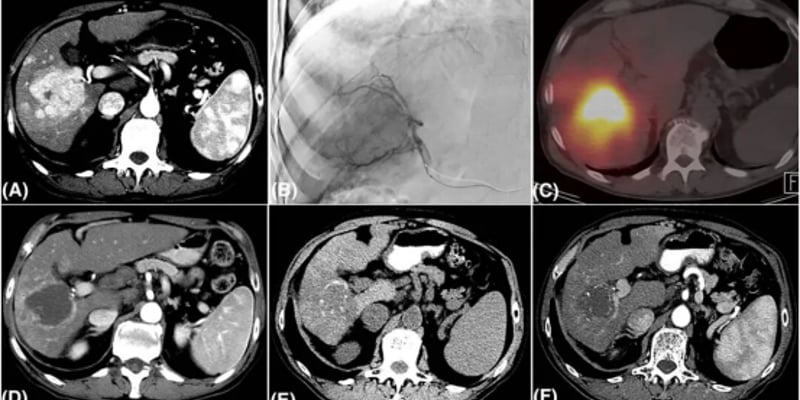
钇90(Y90)树脂微球作为一种重要的局部靶向治疗手段,已被多项国际权威指南推荐用于治疗不可切除的原发性肝癌及肝转移瘤。在法国,国家卫生管理局(HAS)分别于2015年和2018年批准了钇90树脂微球在结直肠癌肝转移(CRLM)和肝细胞癌(HCC)患者中的医保报销。为了更好地评估这项政策的实际效果并收集真实世界数据,法国启动了一系列研究。
基于这一背景,欧洲心血管和介入放射学会(CIRSE)发起了一项名为CIRT-FR的前瞻性多中心观察性研究。该研究的最终结果近期发表在《Cardiovascular and Interventional Radiology》期刊上,旨在评估钇90树脂微球在法国真实世界中应用于结直肠癌肝转移和肝细胞癌患者的效果,并分析法国医保报销标准对临床治疗选择的影响。研究结果令人鼓舞,表明钇90树脂微球治疗不仅安全有效,患者的生活质量也总体保持稳定。
CIRT-FR研究设计与患者特征
CIRT-FR研究纳入了2017年8月至2020年7月期间,来自法国26家医疗中心接受钇90树脂微球治疗的252名患者。其中,193例为肝细胞癌(HCC)患者,59例为结直肠癌肝转移(CRLM)患者。研究团队根据法国HAS的医保报销标准,将患者分为符合报销条件和不符合报销条件的亚组,并对所有患者进行了至少24个月的随访。研究主要评估了患者的总体生存期(OS)、无进展生存期(PFS)、治疗的安全性以及健康相关生活质量(HRQoL)。
法国医保报销标准解析
法国针对钇90树脂微球治疗的医保报销设定了具体的标准:
- 肝细胞癌(HCC)的报销标准:适用于中晚期HCC患者,即根据巴塞罗那临床肝癌(BCLC)分期为B或C的患者;要求无完全性门静脉血栓;东部肿瘤协作组体能状态评分(ECOG)≤2;肝功能Child–Pugh分级为A或B;并且既往不适合接受索拉非尼治疗或对索拉非尼治疗无效。
- 结直肠癌肝转移(CRLM)的报销标准:要求患者ECOG评分≤2;肝内肿瘤负荷小于25%;无肝外疾病;并且对所有已认可的静脉化疗和口服化疗方案耐药或不耐受。
这些标准旨在确保有限的医疗资源用于最可能获益的患者群体。
真实世界研究结果:疗效与安全性
CIRT-FR研究的最终结果显示了钇90树脂微球治疗在真实世界中的表现:
- 生存期:肝细胞癌患者的中位总体生存期(OS)为19.0个月(95% CI 16.1-22.4),结直肠癌肝转移患者的中位OS为10.8个月(95% CI 8.0-13.5)。
- 报销标准的影响:研究发现,无论患者是否符合法国HAS设定的严格报销标准,其总体生存期和治疗安全性结果均无显著差异。
- 亚组分析:早期肝细胞癌患者(BCLC A)和对化疗未产生耐药的结直肠癌肝转移患者表现出更长的生存期。
- 安全性与生活质量:13%的患者报告了与治疗相关的严重不良事件,主要包括疲劳和腹痛。值得注意的是,大多数患者的健康相关生活质量(HRQoL)在治疗后保持稳定,未受到显著影响。
研究结论与政策启示
CIRT-FR研究有力地证明了钇90树脂微球治疗在真实世界临床实践中的良好安全性和有效性,并且治疗对患者的生活质量影响较小。研究结果还提示,当前法国的医保报销标准可能过于严格,部分不完全符合报销标准的患者同样能从治疗中获益。因此,研究建议赋予多学科肿瘤委员会(MDB)更大的决策灵活性,以便根据患者的具体病情和综合评估,更广泛地为患者选择合适的钇90治疗方案。
研究第一作者Maxime Ronot教授表示,他们的研究结果表明钇90树脂微球治疗的适用人群可能比目前严格的报销标准所覆盖的范围更广。未来的医保政策应考虑更多基于临床实际情况的灵活性。
法国经验对其他国家的借鉴意义
法国在钇90治疗的医保报销政策和真实世界临床研究方面积累的经验,为其他国家提供了宝贵的参考。不同国家可以根据自身的医疗资源配置和患者实际需求,借鉴并调整相关的政策。法国的报销标准强调了基于患者具体病情(如肿瘤负荷、肝功能、疾病分期等)的个体化评估,并且政策正逐步向赋予多学科团队(MDT)更多决策权的方向发展。
值得关注的是,目前在中国,钇90治疗尚未被纳入居民或职工医保的报销范围。这凸显了建立一个科学、动态评估体系的重要性,该体系应结合最新的临床研究证据、技术发展以及患者的实际需求,以确保医疗报销政策的时效性和科学性,最终提高肝脏肿瘤高效治疗的可及性。
对于希望了解更多海外前沿靶向药信息或寻求购药途径的患者,可以访问MedFind网站获取帮助。MedFind提供专业的海外靶向药代购服务,以及便捷的AI问诊服务,辅助患者了解病情和治疗方案。此外,网站还提供了丰富的药物信息、诊疗指南等抗癌资讯,帮助患者和家属更好地了解抗癌知识。
相信未来,随着钇90临床应用的不断推广和更多研究结果的涌现,将有助于进一步优化医疗政策和报销标准,让更多有需要的肝脏肿瘤患者能够获得这一有效的治疗手段。