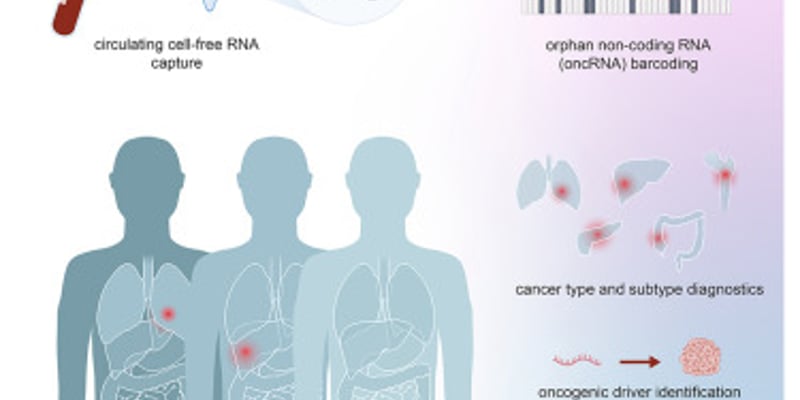
乳腺癌,作为全球女性发病率最高的恶性肿瘤之一,不仅威胁着无数生命,也给患者及家庭带来了沉重的身心负担。尽管手术、化疗、放疗、靶向治疗和内分泌治疗等传统手段不断进步,但其副作用、耐药性、复发转移等问题,依然是摆在医学界面前的一道道难题。因此,开发更精准、更高效、副作用更小的创新疗法,成为科研人员孜孜不倦的追求。
在肿瘤治疗的前沿领域,光诊疗技术(Phototheranostics)正以其独特的“诊断与治疗一体化”优势,受到越来越多的关注。它能像“智能导航导弹”一样,在实时监测肿瘤位置的同时,精准地对其进行局部打击,大大提升了治疗的精准度和安全性。然而,现有的光诊疗试剂仍面临诸多挑战,例如生物相容性不佳、合成复杂、深部组织穿透性不足以及可能存在的长期毒性蓄积等问题。
近期,一项来自香港中文大学、香港科技大学唐本忠院士团队,联合香港科技大学林荣业、宁夏大学马海军和李乐团队的突破性研究,为乳腺癌患者带来了新的希望。他们设计了一种创新的非富勒烯受体材料——DB-QX-asy-4F,并将其开发为一种多功能光诊疗试剂。这项研究的关键在于,它巧妙地整合了两种独特的细胞死亡机制——铁死亡(Ferroptosis)与泛凋亡(PANoptosis),实现了对乳腺癌的协同治疗。这一成果于2026年1月29日在线发表在国际权威期刊《ACS Nano》上,为光诊疗试剂的研发及其在精准肿瘤治疗中的应用,奠定了坚实的基础。
乳腺癌:女性健康面临的严峻挑战与现有治疗的困境
乳腺癌的普遍性与传统治疗手段的不足
乳腺癌是女性最常见的恶性肿瘤,尤其在中老年女性中,其发病率居高不下。它不仅严重威胁女性的生命健康,治疗过程中也常伴随着巨大的生理和心理压力。目前,乳腺癌的治疗方案通常是多学科综合治疗,包括外科手术切除肿瘤,术后辅以放射治疗清除残余癌细胞,以及全身性的化学治疗、内分泌治疗和靶向治疗等。
- 手术:虽然是根治性治疗的重要手段,但对患者身体创伤大,术后恢复期长,且有复发和转移的风险。
- 化疗与放疗:这两种传统疗法在杀死癌细胞的同时,也常常“误伤”正常细胞,导致脱发、恶心、呕吐、骨髓抑制等严重副作用,极大地影响了患者的生活质量。长期化疗还会引发癌细胞耐药性,使得治疗效果大打折扣。
- 靶向治疗与内分泌治疗:这些相对精准的治疗方式虽然副作用较小,但并非对所有患者都有效,且部分患者仍会产生耐药,最终导致疾病进展。
这些局限性促使科学家们不断探索更智能、更温和、更有效的抗癌策略,以期为患者提供更优质的治疗选择。
光诊疗技术:肿瘤精准治疗的新篇章,挑战与机遇并存
在寻找新疗法的道路上,光诊疗技术(Phototheranostics)异军突起,被誉为精准肿瘤治疗的“新星”。它通过将诊断成像与治疗功能巧妙地整合到单一的纳米平台上,实现了对肿瘤的“边看边治”。简单来说,就是医生可以通过先进的成像技术(如荧光成像、光声成像等)精准地定位肿瘤,然后利用特定波长的光激活纳米材料,对肿瘤进行局部治疗。
光诊疗的优势显而易见:
- 高选择性:主要作用于肿瘤区域,减少对健康组织的损伤。
- 微创性:无需大范围手术,降低患者痛苦。
- 实时监控:治疗过程可视化,医生可根据实时反馈调整策略。
- 强治疗效能:通过光动力、光热等多种机制协同抗癌。
然而,现有的光诊疗试剂也面临着一些亟待解决的挑战:
- 生物相容性不足:部分材料可能在体内引发不良反应。
- 合成复杂:制备过程耗时费力,成本较高。
- 近红外(NIR)光谱可调性有限:在深部组织成像和治疗效果受限。
- 长期生物蓄积毒性:部分材料可能在体内残留,带来潜在毒性风险。
为了克服这些瓶颈,研究人员将目光投向了有机小分子试剂,特别是非富勒烯受体(NFA)材料。这类材料因其独特的分子结构和优异的光学特性,被认为是开发新一代高性能光诊疗剂的理想选择。MedFind作为专注于抗癌新药和前沿疗法的平台,一直密切关注此类创新技术的发展,希望能将最新的科研成果以最直观的方式呈现给广大病友。

香港中文大学的突破性进展:DB-QX-asy-4F纳米系统
非富勒烯受体材料:光诊疗的“潜力股”
非富勒烯受体(NFA)材料最初是为有机太阳能电池而开发的,但科学家们很快发现,凭借其独特的分子结构和出色的光物理化学性质,NFA在生物医学领域,特别是光诊疗方面,展现出巨大的潜力。NFA材料通常采用“给体-受体-给体(D-A-D)”或“受体-给体-受体(A-D-A)”的分子骨架,具有强大的分子内电荷转移(ICT)效应。
通过精细调控其端基、共轭核心和侧链,NFA材料可以实现:
- 将吸收光谱拓展到更深的近红外二区(NIR-II,1000-1700纳米),这意味着光能更好地穿透深层组织,提高治疗深度。
- 显著增强光热转换效率(PCE),即光能转化为热能的效率更高。
- 提高活性氧(ROS)的生成能力,增强光动力治疗效果。
- 拥有更好的光稳定性和生物安全性。
这些特性使得NFA材料在深部组织的光热治疗(PTT)、光动力治疗(PDT)以及荧光成像(FLI)方面,都表现出传统材料难以比拟的优势。也正因如此,它们成为新一代多功能光诊疗试剂的重要候选者。
DB-QX-asy-4F:一种革新的A-D-A’-D-A型非富勒烯受体材料
为了进一步提升NFA材料在光诊疗领域的性能,香港中文大学唐本忠团队的科研人员巧妙地设计了一种新型的非富勒烯受体材料,命名为DB-QX-asy-4F。这种材料具有独特的A-D-A’-D-A分子构型,与传统的D-A-D/A-D-A型NFA相比,它引入了电负性相对较低的喹啉酮(Qx)作为核心单元,取代了常用的BTZ核心。
这种创新的设计带来了多重优势:
- 优化能级排列:更好地吸收光能,并高效地转化为治疗能量。
- 简化合成流程:降低了材料的制备难度和成本。
- 提升生物相容性:通过整合烷基侧链与Y形三臂对称结构,使材料在体内更安全、更稳定。
- 多功能集成能力:在深层组织NIR-II发光、高光热转换效率以及产生双型活性氧方面均表现出色。
当DB-QX-asy-4F与二硬脂酰基磷脂酰乙醇胺-聚乙二醇-环肽RGD(DSPE-mPEG-cRGD)进行自组装后,就形成了具有良好生物相容性的纳米颗粒,被研究团队称为DB-QX-asy-4F NPs。这些纳米颗粒正是实现精准诊断和高效治疗的“智能武器”。
“智能”抗癌助手:DB-QX-asy-4F纳米颗粒的多功能表现
DB-QX-asy-4F NPs的诞生,不仅仅是合成了一种新材料,更重要的是,它集成了多种强大的功能,使其成为一个“多面手”,能在诊断和治疗乳腺癌的过程中发挥关键作用。
精准“定位”癌细胞:高分辨率影像引导
在治疗肿瘤前,医生首先需要准确知道肿瘤在哪里,有多大,边界是否清晰。DB-QX-asy-4F NPs在这方面表现卓越:
- 强效近红外二区(NIR-II)荧光发射:纳米颗粒在体内被特定光激发后,能发出波长在1000-1700纳米范围内的荧光。这个波段的光相比可见光和近红外一区光,能更深地穿透生物组织,同时减少组织对光的散射和吸收,从而获得更高分辨率的深部组织图像。这意味着医生能够更清晰、更精准地看到肿瘤的位置,甚至发现传统成像难以察觉的微小病灶。
- 斯托克斯位移大,量子产率高:该纳米颗粒的斯托克斯位移达到了230纳米(甚至高达235纳米),量子产率为1.97%。这些专业术语意味着它能有效避免激发光对荧光信号的干扰,提供更纯净、更高信噪比的图像,进一步提升了成像质量。
- 多模态成像能力:除了高分辨率荧光成像,DB-QX-asy-4F NPs还能实现光声成像和清晰的血管成像。光声成像能提供组织深部的解剖和功能信息,结合荧光成像,医生可以获得更全面的肿瘤信息,包括其内部结构和周围血管分布,为后续治疗提供精确的导航。
这种强大的诊断能力,确保了治疗的精准性,避免了对健康组织的误伤。
双重“打击”肿瘤:光热与光动力的协同作用
在精准定位肿瘤后,DB-QX-asy-4F NPs就开始发挥其强大的治疗功能。它能同时进行光热治疗(PTT)和光动力治疗(PDT),实现对肿瘤的“双重打击”。
- 光热治疗(PTT):当用635纳米的激光照射DB-QX-asy-4F NPs时,这些纳米颗粒能高效吸收光能并将其转化为热能,迅速使肿瘤局部温度升高。实验数据显示,其光热转换效率(PCE)高达48.49%,远优于多数已报道的非富勒烯受体系统。局部高温可以像“小刀”一样,直接灼烧并杀死癌细胞,同时也能损伤肿瘤周围的血管,切断肿瘤的营养供应,从而抑制肿瘤的生长。
- 光动力治疗(PDT):除了产生热量,光照还能触发DB-QX-asy-4F NPs产生大量的活性氧(ROS)。活性氧是高度活泼的氧自由基,对细胞有很强的氧化损伤作用。这项研究发现,该纳米颗粒能高效产生两种主要的活性氧:
- I型ROS:包括超氧阴离子(・O₂⁻)和羟基自由基(・OH),它们能直接破坏细胞内的蛋白质、核酸和脂质,导致细胞功能失调。
- II型ROS:主要是单线态氧(¹O₂),它也能引发细胞膜脂质过氧化,对癌细胞造成致命损伤。
- 这些活性氧能够放大癌细胞内部的氧化应激反应,营造一种极端不利于肿瘤细胞生存的胞内环境,从而启动一系列细胞死亡程序。
PTT和PDT的协同作用,好比“拳头加利剑”,既能通过高温直接杀伤癌细胞,又能通过活性氧从内部瓦解癌细胞,实现了1+1大于2的抗癌效果。

揭秘癌细胞“自杀”新机制:铁死亡与泛凋亡
癌细胞并非只有一种死亡方式。除了我们熟知的细胞凋亡(Apoptosis,一种程序性细胞死亡,可以理解为细胞的“自杀”程序),近年来科学家们发现了多种不同的受调控细胞死亡方式,它们对肿瘤的发生发展和治疗响应都有重要影响。这项研究重点关注了其中两种特殊的死亡机制:铁死亡和泛凋亡。
铁死亡(Ferroptosis):一种独特的铁依赖性死亡
铁死亡是一种近年来发现的、区别于传统凋亡的、由铁离子依赖性脂质过氧化引发的细胞程序性死亡。简单来说,就是细胞内过多的铁离子导致细胞膜上的脂质(脂肪成分)被过度氧化,从而损伤细胞膜,最终导致细胞死亡。
铁死亡的特点:
- 铁依赖性:细胞内铁代谢异常是其关键驱动因素。
- 脂质过氧化:过量的活性氧攻击细胞膜脂质,导致细胞膜结构和功能受损。
- 非凋亡形式:与细胞凋亡在形态学和生化机制上都有明显区别。
许多癌细胞为了快速增殖,往往对铁的需求量很高,这也使得它们更容易受到铁死亡的攻击。诱导癌细胞发生铁死亡,被认为是克服肿瘤耐药性和提升治疗效果的重要策略。在铁死亡的调控中,GPX4(谷胱甘肽过氧化物酶4)、ALOX15(15-脂氧合酶)和FSP1(铁死亡抑制蛋白1)等分子起着关键作用。
泛凋亡(PANoptosis):多种死亡途径的“大集合”
泛凋亡是一个更广泛的概念,它指的是多种受调控的细胞死亡途径的集合,包括坏死性凋亡(Necroptosis)、焦亡(Pyroptosis)等。它不再是单一的死亡模式,而是多种模式的“协同作用”,共同导致细胞的死亡。
泛凋亡的特点:
- 多通路激活:可以同时激活或协同激活凋亡、坏死性凋亡和焦亡等多种细胞死亡通路。
- 克服耐药性:当癌细胞对单一的细胞死亡通路产生耐药时,泛凋亡能够通过激活其他通路来绕过耐药,继续杀伤癌细胞。
- 炎症反应:部分泛凋亡(如焦亡)会伴随炎症反应,这在某些情况下可以激活机体的免疫系统,进一步清除肿瘤细胞。
这项研究发现,DB-QX-asy-4F NPs能够同时激活凋亡、坏死性凋亡和焦亡通路。例如,在凋亡通路中,它能下调Bcl-2(抑制凋亡的蛋白)的表达,上调Bax(促进凋亡的蛋白)的表达,并激活Caspase-3(执行凋亡的关键酶)。在坏死性凋亡通路中,它能激活TNF-α信号通路,磷酸化RIPK3(受体相互作用蛋白激酶3)并激活MLKL(混合谱系激酶结构域样蛋白),最终导致细胞膜破裂。而在焦亡通路中,它能切割Caspase-1(半胱氨酸天冬氨酸蛋白酶-1),形成GSDMD-N片段(Gasdermin D N端片段),并释放促炎细胞因子IL-1β和IL-18,引起细胞裂解性死亡。
通过同时激活这些复杂的死亡通路,DB-QX-asy-4F NPs能够从多个维度瓦解癌细胞,大大提升了抗肿瘤的疗效。
强强联合:DB-QX-asy-4FNPs如何精准诱导双重细胞死亡?
现在,我们已经了解了DB-QX-asy-4F NPs的多功能诊断和治疗能力,以及铁死亡和泛凋亡这两种特殊的细胞死亡机制。那么,这项研究最核心的突破点在于,DB-QX-asy-4F NPs是如何将这些机制巧妙地整合起来,从而实现对乳腺癌的协同治疗的呢?
从分子层面看DB-QX-asy-4FNPs的作用机制
当DB-QX-asy-4F NPs在激光照射下被激活时,它就像一个“双刃剑”,同时启动了光热效应和活性氧生成,这些效应共同构成了诱导癌细胞死亡的强大驱动力。
1. 诱导泛凋亡:多重通路共同瓦解癌细胞
- 氧化应激与热损伤:DB-QX-asy-4F NPs产生的大量活性氧(ROS)和局部高温,对癌细胞造成了严重的氧化应激和热损伤。这种环境压力直接打破了细胞内的平衡,促使细胞启动自毁程序。
- 激活凋亡通路:在纳米颗粒的作用下,癌细胞内的促凋亡蛋白Bax表达增加,而抗凋亡蛋白Bcl-2表达降低。这种“此消彼长”打破了细胞内凋亡的平衡,同时关键的执行者Caspase-3被激活,直接导致细胞走向凋亡。
- 启动坏死性凋亡:除了凋亡,DB-QX-asy-4F NPs还能激活癌细胞的坏死性凋亡通路。它通过激活TNF-α(肿瘤坏死因子-α)信号通路,并导致RIPK3和MLKL这两个关键蛋白的磷酸化,最终促使细胞膜破裂,细胞内容物释放。
- 引发焦亡:更令人振奋的是,这项研究还发现DB-QX-asy-4F NPs能够诱导癌细胞的焦亡。焦亡是一种伴随强烈炎症反应的细胞死亡方式。纳米颗粒激活Caspase-1,进而切割GSDMD蛋白,形成具有膜孔形成能力的GSDMD-N片段,导致细胞肿胀破裂。同时,焦亡还会释放促炎细胞因子IL-1β和IL-18,这些细胞因子可能进一步招募免疫细胞,增强抗肿瘤免疫反应。
2. 启动铁死亡:釜底抽薪,切断癌细胞生路
- ROS诱导脂质过氧化:DB-QX-asy-4F NPs生成的大量活性氧,是启动铁死亡的关键因素。这些ROS直接攻击癌细胞膜上的不饱和脂肪酸,导致严重的脂质过氧化。脂质过氧化产物的堆积,会严重损害细胞膜的完整性和功能。
- 影响铁死亡关键分子:研究进一步发现,纳米颗粒能改变铁死亡相关分子(如GPX4、ALOX15、FSP1)的表达水平,从内部调控铁死亡通路,促使癌细胞发生铁死亡。
3. 协同效应:多维度抗癌,克服耐药
最重要的是,铁死亡与泛凋亡通路之间并非独立作用,而是相互促进,形成了一种多维度的治疗策略。当癌细胞试图通过阻断单一死亡通路来抵抗治疗时,DB-QX-asy-4F NPs可以同时激活其他通路,让癌细胞无路可逃。这种“组合拳”式的打击,能够显著放大治疗效果,有效克服肿瘤因单一死亡通路逃逸而产生的耐药性。
这项研究的独特价值与未来潜力
唐本忠团队的这项研究不仅开发出了一种高效的非富勒烯受体光诊疗材料,更重要的是,它深入揭示了该材料介导肿瘤细胞死亡的复杂分子机制。它填补了在基于NFA的光诊疗体系中,铁死亡与泛凋亡之间分子串扰的研究空白,为理解光诊疗试剂发挥作用的潜在机制奠定了基础。这不仅拓宽了我们对NFA介导肿瘤治疗机制的理解,也为未来设计更智能、更精准的光诊疗试剂,并推动其向临床转化,提供了全新的思路和坚实的科学依据。
展望未来:精准肿瘤治疗的新篇章
香港中文大学唐本忠团队的这项研究,无疑是乳腺癌治疗领域一个令人振奋的突破。虽然DB-QX-asy-4F纳米系统目前仍处于实验室研究阶段,距离临床应用还有漫长的道路,但这为乳腺癌乃至其他多种恶性肿瘤的治疗,描绘了一个充满希望的蓝图。
对于广大患者和家属而言,这项研究的意义在于:
- 更精准的治疗前景:未来的光诊疗技术,有望实现对肿瘤的更精确诊断和更局部、更彻底的清除,最大程度地减少对健康组织的损伤。
- 更低的副作用负担:与传统的放化疗相比,光诊疗技术通过靶向作用于肿瘤,理论上能显著降低全身性副作用,从而提高患者的治疗耐受性和生活质量。
- 克服耐药性的新策略:通过同时激活铁死亡和泛凋亡等多种细胞死亡通路,为解决肿瘤耐药这一棘手问题提供了新的思路,有望延长患者的生存期。
MedFind作为您值得信赖的抗癌信息共享平台,将持续关注这类前沿的科研进展,为您提供最新、最权威的抗癌资讯和药物信息。我们深知每一位患者和家属对“生”的渴望,因此,我们致力于将全球领先的抗癌新药和治疗方案带到您的身边。未来,类似DB-QX-asy-4F这样兼具诊断和治疗功能的智能系统,一旦成功应用于临床,将可能彻底改变肿瘤的治疗格局。
我们鼓励您保持积极心态,主动了解最新的治疗信息,并与您的主治医生充分沟通。当您对最新的抗癌药物或治疗方案有疑问时,MedFind可以为您提供AI辅助问诊服务,帮助您更好地理解复杂医学信息。同时,我们也能协助您寻找和构建海外购药渠道,确保您能及时获取国内外尚未上市但对病情有益的创新药物。让我们一起,为战胜癌症而努力!
参考资料:ACS Nano 原文链接