对于无数癌症患者和他们的家庭来说,每一次医学研究的新进展,都如同在漫漫长夜中看到的一线曙光。癌症,这个复杂而顽固的敌人,科学家们一直在努力揭示它的奥秘,寻找更有效、更精准的治疗方法。今天,我们很高兴能为您带来一项来自南方医科大学的重磅研究成果,这项发表在国际顶尖期刊《自然·癌症》(Nature Cancer)上的研究,揭示了我们体内一种“隐形密码”——N6-甲基腺苷(m6A)修饰——在癌症发生发展中的关键作用,特别是在前列腺癌领域,它可能为未来的精准治疗开辟新的道路。
癌症治疗的“隐形密码”:N6-甲基腺苷(m6A)修饰是什么?
要理解这项研究的重要性,我们首先要了解什么是m6A修饰。想象一下,我们身体里的每一个细胞都像一个高度精密的工厂,而我们的基因就是工厂的设计图纸。这些设计图纸上的信息,需要通过一种叫做RNA的“信使”来传递,指导工厂生产各种蛋白质,这些蛋白质就是工厂里工作的“机器”。
m6A,全称N6-甲基腺苷,就像是这些RNA“信使”身上的一个特殊“标签”或“邮戳”。这个标签不是随便打的,它非常重要,因为它能决定RNA的“命运”:比如这个信使是应该快速完成任务后被销毁,还是应该长时间存在,反复传递信息?是应该大量生产蛋白质,还是应该适量生产?这个小小的m6A标签,就像一个交通信号灯,精确地控制着基因信息的传递速度和效率。
在正常细胞中,m6A修饰的动态平衡对细胞的正常功能至关重要。它参与了RNA的各个生命阶段,包括RNA的剪接(裁剪和连接)、翻译(根据指令生产蛋白质)以及降解(完成任务后被回收)。一旦这个平衡被打破,m6A标签被打错了位置,或者“阅读”标签的机制出了问题,就可能导致细胞失控,从而诱发或加速癌症的发生发展。许多研究都表明,m6A调控因子的异常与多种癌症的发生密切相关,它们影响着癌细胞的增殖、转移和对治疗的抵抗。
m6A的“管理者”:书写者、擦除者和阅读者
为了更好地理解m6A的作用,我们可以把它想象成一个精密的“管理团队”:
- “书写者”(Writers): 负责把m6A标签“写”到RNA上。主要的“书写者”团队包括METTL3-METTL14-WTAP等蛋白质复合物。它们就像是负责盖章的邮政人员,把重要的标记盖上去。
- “擦除者”(Erasers): 负责把m6A标签“擦掉”。比如FTO和ALKBH5,它们像是邮局的纠错员,如果标签错了或者完成了任务,就会被擦除。
- “阅读者”(Readers): 负责“识别”m6A标签并执行相应的命令。这一类蛋白质包括YTH结构域蛋白家族(如YTHDF1、YTHDF3),以及HNRNP和IGF2BP家族成员。它们就像是邮局的投递员,根据标签上的信息,决定这份RNA信使是该被加速投递,还是该被延缓处理。
这些“书写者”、“擦除者”和“阅读者”之间的协同作用,共同精细地调控着细胞内数千种RNA的命运,进而影响到几乎所有的细胞活动。在癌症中,这些关键角色的突变或失调,就像是邮局系统出了故障,导致错误的指令被传递,最终促使肿瘤的形成和恶化。
传统研究的局限与新工具的诞生:METTL3编辑系统
尽管m6A修饰在癌症中的重要性日益凸显,但长期以来,研究人员面临着一个巨大的挑战:如何精准地找到哪些m6A位点是真正“功能性”的,也就是对癌症发生发展起决定性作用的?传统的m6A研究方法往往只能提供一个整体的图景,像是在茫茫森林中知道有许多树,却很难分辨哪一棵树是这片森林的“命脉”。由于m6A修饰存在于成千上万个RNA分子上的无数个位点,要找出其中真正关键的“那几个”,无疑是大海捞针。
为了解决这一难题,南方医科大学何厚胜教授和许鑫教授团队开发出了一套革命性的新工具——基于METTL3的转录组编辑筛选平台。这项技术就像是为m6A研究配备了一台高度精准的“标签定制打印机”。研究人员可以精确地选择特定的RNA区域,利用这个系统在上面“打印”m6A标签,然后观察细胞的行为变化。通过这种“高通量”的筛选方式(就像一个巨大的筛选器,能同时检测成千上万个目标),他们可以快速而有效地找出那些一旦被打上m6A标签就会显著影响细胞增殖、分化或死亡的“功能性”m6A位点。
这项技术的出现,彻底改变了m6A研究的格局,使得科学家能够从过去的“宏观观察”转向“精准定位”,极大地加速了我们对m6A在癌症中作用机制的理解,为发现新的癌症治疗靶点提供了强大的技术支持。
前列腺癌与肺癌的突破性发现:CHD9基因的秘密
利用他们开发的创新METTL3转录组编辑筛选平台,何厚胜和许鑫教授团队在前列腺癌和肺癌模型中开展了大规模的筛选工作。这项研究的主要目标是识别那些对癌细胞增殖具有关键调控作用的功能性m6A修饰位点。结果令人振奋:他们发现了222个能够调节细胞增殖的m6A位点,其中许多位点都以“细胞类型特异性”的方式发挥作用。这意味着,同一个m6A修饰在不同类型的癌细胞中(例如前列腺癌细胞和肺癌细胞)可能扮演着不同的角色,这进一步强调了癌症治疗需要个性化的重要性。
在这222个位点中,一个名为CHD9的基因上的m6A位点引起了研究团队的特别关注。这项研究首次明确指出,CHD9基因是前列腺癌中的一个强大的“肿瘤抑制基因”。肿瘤抑制基因可以被理解为细胞内的“刹车系统”,它们能够阻止细胞无限制地生长和分裂,从而抑制肿瘤的形成和发展。当“刹车系统”失灵时,癌细胞就会肆无忌惮地生长。
更令人惊喜的是,研究人员发现,在CHD9基因上的特定m6A位点的修饰,能够显著增加CHD9蛋白质的丰度。就像在设计图纸(基因)上盖了一个特殊邮戳(m6A),这个邮戳告诉工厂(细胞)要加大力度生产某个关键的“机器”(CHD9蛋白质)。当CHD9蛋白质增多时,它就能更有效地发挥“刹车”作用,抑制前列腺癌细胞的增殖。在进一步的动物实验(异种移植物模型)中,研究团队也证实了这种m6A依赖性的CHD9蛋白增加,确实能够显著减弱肿瘤的生长。
这项发现为我们理解前列腺癌的发生机制提供了全新的视角,也为开发针对前列腺癌的创新治疗策略指明了方向。通过靶向调控CHD9的m6A修饰,我们或许能够重新激活癌细胞的“刹车系统”,从而有效遏制肿瘤的进展。
深入剖析:CHD9如何发挥肿瘤抑制作用?
这项研究不仅仅停留在发现层面,更深入地揭示了CHD9在m6A修饰下如何精确地发挥肿瘤抑制作用的分子机制。这是一个精妙的分子调控网络,我们可以将其简化理解为一系列“联动反应”:
- m6A标签的“阅读”与蛋白质生产: 前面我们提到,m6A标签需要“阅读者”来识别。研究发现,CHD9基因上的m6A修饰,正是通过招募YTHDF1和YTHDF3这两种“阅读者”蛋白,来增强CHD9蛋白质的“翻译”过程。你可以把YTHDF1和YTHDF3想象成两位高效的“翻译官”,它们识别到CHD9 RNA上的m6A标签后,就会加速“翻译”过程,让细胞更快、更多地生产出CHD9蛋白质。蛋白质是执行细胞功能的分子机器,蛋白质数量的增加,意味着CHD9的“刹车”功能得到了加强。
- CHD9与MYBBP1A的“搭档”: 增加后的CHD9蛋白质,在细胞核和细胞质之间穿梭,并找到一个新的“搭档”——MYBBP1A蛋白。MYBBP1A通常存在于细胞核中的一个叫做“核仁”的区域,核仁是细胞内一个重要的“活动中心”,参与许多细胞生命活动。CHD9与MYBBP1A的相互作用,就像CHD9主动“拉”住了MYBBP1A,将它从繁忙的“核仁指挥中心”中“分离”出来。
- 激活肿瘤抑制信号CDKN1A (p21): MYBBP1A被CHD9“拉出来”后,产生了一系列下游的连锁反应,最终导致CDKN1A (p21)相关的肿瘤抑制信号被激活。p21是一个非常重要的“细胞周期检查点”蛋白,它就像细胞分裂过程中的一个“红灯”,一旦被激活,就会阻止细胞进入下一轮分裂。对于癌细胞来说,它们往往会绕过这些“红灯”,从而无限增殖。而通过m6A修饰激活CHD9,进而激活p21,就相当于重新亮起了癌细胞的“红灯”,强迫它们停止无序的分裂。
总结来说,整个机制链条是这样的: m6A修饰打在CHD9 RNA上 → YTHDF1和YTHDF3“阅读”这个标签,加速CHD9蛋白质的生产 → 更多的CHD9蛋白质与MYBBP1A结合,并将其从核仁中“移出” → 这进一步激活了CDKN1A (p21)这个重要的肿瘤抑制因子 → 最终,癌细胞的增殖受到抑制,肿瘤生长被减弱。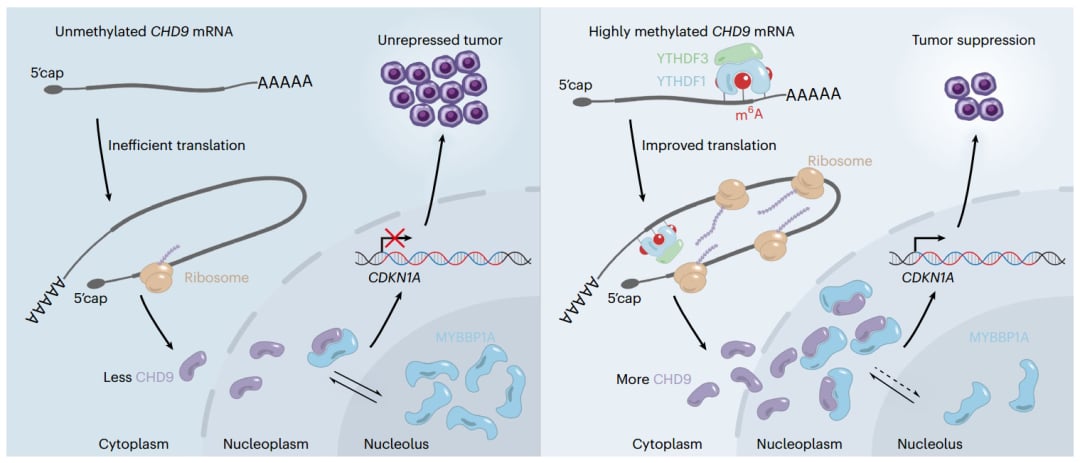
这项研究对癌症患者意味着什么?
这项由南方医科大学团队完成的m6A研究,无疑为癌症治疗领域带来了令人鼓舞的新希望,尤其对前列腺癌患者及其家庭具有深远的意义。虽然这项研究目前仍处于基础科学发现阶段,距离临床应用还需要漫长的转化过程,但它所揭示的机制,为我们描绘了一幅未来精准医疗的蓝图:
- 新的诊断与预后标志物: 既然CHD9上的m6A修饰与肿瘤抑制功能密切相关,那么未来医生或许可以通过检测患者体内CHD9基因m6A修饰的水平或状态,来更早期、更精准地诊断前列腺癌,评估疾病的进展,甚至预测患者对某些治疗的反应。这可能比现有的诊断方法更灵敏、更特异。
- 全新的靶向治疗策略: 这项研究指出了一个明确的分子靶点——CHD9基因及其m6A修饰。基于此,科学家可以开发出特异性药物或基因疗法,来精确地调控CHD9的m6A水平,从而增强其肿瘤抑制功能。例如,未来可能会出现能够“写入”或“擦除”特定m6A标签的药物,或者增强m6A“阅读者”功能的药物,这些都可能成为对抗癌症的“精准制导武器”。对于那些现有治疗方案效果不佳的前列腺癌患者,这种新的靶向策略无疑提供了新的希望。
- 个性化治疗的基石: 考虑到m6A修饰在不同细胞类型中可能具有特异性功能,这项研究也强调了未来癌症治疗应向个性化发展。通过分析每个患者肿瘤细胞中m6A修饰的独特模式,医生可以为患者量身定制最有效的治疗方案,实现真正的“精准医疗”。
- 推动RNA修饰研究: 这项研究不仅为m6A的功能定位建立了可扩展的框架,也为其他RNA修饰(如m5C、m1A等)的系统性探索铺平了道路,预示着未来在“表观转录组学”(即RNA修饰的研究领域)将有更多突破性的发现,从而更全面地理解癌症的复杂性。
作为MedFind,我们深知患者和家属对最新抗癌信息和治疗选择的渴望。这项研究正体现了我们所关注的前沿科学进展,它为癌症患者带来了新的希望和更多可能。我们致力于持续关注和分享这些突破性的研究,帮助您了解最新的科学发现如何转化为未来的治疗方案。
面对癌症:MedFind如何帮助您?
面对复杂多变的癌症,获取及时、准确、专业的医疗信息至关重要。作为由癌症患者家属发起的抗癌信息共享平台,MedFind致力于为广大的患者和家庭提供最全面的支持和帮助。我们理解您在求医问药过程中的焦虑与困惑,因此我们通过以下服务,希望能为您带来实实在在的价值:
- 全球抗癌药品跨境直邮: 新的医学发现往往预示着新药的诞生。当基于m6A或CHD9机制的新型抗癌药物未来问世时,MedFind将紧密追踪其全球上市和审批动态。我们能协助您了解和获取包括国内未上市的全球前沿抗癌药物,通过合法合规的跨境直邮渠道,让您第一时间接触到最新的治疗选择,解决购药难题。
- 权威抗癌资讯、诊疗指南和药物信息: 癌症治疗日新月异,最新的研究成果和诊疗指南层出不穷。MedFind平台持续更新包括m6A研究在内的各类前沿抗癌资讯、全球权威诊疗指南和详细的药物信息。我们以通俗易懂的语言,为您解读复杂的医学知识,帮助您紧跟国际抗癌治疗的最新趋势,做出明智的治疗决策。
- AI辅助问诊: 面对大量的医学报告和专业的术语,您可能会感到无所适从。MedFind提供AI辅助问诊服务,利用人工智能技术,帮助您更好地理解病情,分析复杂的临床数据,评估不同治疗方案的利弊,并提供个性化的建议。我们的AI工具可以作为您与医生沟通的有力助手,让您更自信、更清晰地参与到自己的治疗决策中来。
这项关于m6A和CHD9的研究,再次证明了人类在对抗癌症的道路上从未止步。每一次微小的突破,都可能汇聚成改变命运的巨大力量。MedFind愿与您携手,共同关注这些希望之光,为您的抗癌之路提供坚实的支持。如果您有任何疑问或需要进一步的帮助,请随时联系我们,我们专业的团队将竭诚为您服务。
参考文献
He, H., Xu, X. METTL3-based epitranscriptomic editing screening identifies functional m6A sites in cancers. Nature Cancer (2026). https://www.nature.com/articles/s43018-026-01117-2