在与癌症抗争的漫长旅途中,我们通常将目光聚焦在肿瘤本身、化疗、靶向药或是免疫治疗上。然而,您是否曾想过,在身体里,还存在着一个被忽视的“盟友”或“敌人”?它就是我们肠道中数以万亿计的微生物大军——肠道菌群。这些微小的生命不仅影响着我们的消化吸收,更可能在无形中决定着一场场抗癌战争的胜负。最新的科学研究正逐渐揭开这层神秘面纱,发现肠道菌群竟能通过“偷吃”我们饮食中的一种常见氨基酸——天冬酰胺,从而深刻影响癌症的进程,甚至左右免疫治疗的效果。这对于数百万饱受结直肠癌等恶性肿瘤折磨的患者和家庭而言,无疑是带来了全新的希望与思考。
一、肠道:被忽视的“抗癌前线”——肠道菌群与癌症的复杂关系
想象一下,在您身体的深处,特别是肠道这个“秘密基地”里,居住着一个庞大而复杂的生态系统。这里有上万亿的细菌、病毒和真菌,它们的总重量甚至超过了您的大脑!我们称它们为肠道菌群。长期以来,我们可能只知道它们帮助消化食物、吸收营养,但近年来,科学家们惊讶地发现,这些“微观盟友”的能力远不止于此。
肠道菌群不仅是营养物质的“加工厂”,更是我们身体免疫系统的“训练营”和“调控中心”。它们产生的代谢产物,能够直接或间接影响全身的生理功能,包括炎症反应、新陈代谢,甚至大脑功能。而当这个精密的生态系统失衡时,各种疾病也可能随之而来,其中就包括癌症。越来越多的证据表明,肠道菌群的组成和功能,与肿瘤的发生发展、对治疗的反应以及预后息息相关。理解肠道菌群如何参与癌症的“斗争”,正成为现代癌症研究的关键。
1. 为什么肠道菌群如此重要?
- 营养吸收与代谢:菌群能分解人体无法消化的膳食纤维,产生短链脂肪酸(如丁酸),为肠道细胞提供能量,并影响全身的能量代谢。
- 免疫系统调节:它们与肠道免疫细胞直接“对话”,训练免疫系统识别“好人”与“坏人”,维持免疫平衡,防止过度炎症或免疫力低下。
- 屏障功能维护:健康的肠道菌群有助于维持肠道黏膜的完整性,阻止有害物质进入血液,保护身体免受感染和炎症的侵害。
- 抗癌潜力:一些益生菌被发现能直接抑制癌细胞生长,或增强抗癌药物的疗效。
2. 菌群失衡:癌症的潜在推手
当肠道菌群的平衡被打破时(例如,有害菌增多,有益菌减少),这种失衡被称为“菌群失调”。菌群失调可能导致:
- 慢性炎症:长期的肠道炎症是许多癌症(特别是结直肠癌)发生发展的重要因素。
- 免疫抑制:某些菌群可能产生抑制免疫细胞活性的物质,使得免疫系统无法有效识别和攻击癌细胞。
- 代谢异常:菌群失调可能改变氨基酸、脂肪酸等营养物质的代谢路径,为癌细胞提供生长所需的“燃料”。
二、揭开“营养分配官”的面纱:天冬酰胺与卵形拟杆菌的秘密
在一项发表于国际权威杂志《Cell Host & Microbe》的重磅研究中,来自威尔康奈尔医学院的科学家们,通过深入探究肠道菌群如何影响癌症进程,首次为我们描绘了一幅清晰的“营养争夺战”图景。他们发现,一种名为卵形拟杆菌(Bacteroides ovatus)的肠道细菌,竟然通过其携带的一个名为bo-ansB基因,精准地调控着一种氨基酸——天冬酰胺的流向,从而深刻影响着结直肠癌的进展和抗癌免疫力。
1. 什么是天冬酰胺?癌症细胞和免疫细胞的“生命之粮”
在深入了解这项研究之前,我们首先需要认识一下天冬酰胺。它是一种常见的非必需氨基酸,广泛存在于我们日常的肉类、乳制品、坚果、土豆和芦笋等食物中。在细胞层面,天冬酰胺扮演着至关重要的角色:它是蛋白质合成的基石,也是细胞生长、增殖和存活所必需的关键营养物质。对于快速分裂的癌细胞来说,天冬酰胺简直就是“生命之粮”,能为它们提供快速生长的能量和材料。
然而,令人意想不到的是,在身体的“抗癌战场”上,负责攻击癌细胞的“免疫勇士”——CD8+ T细胞,也同样高度依赖天冬酰胺来维持它们的活力和杀伤功能。这就形成了一个独特的局面:肿瘤微环境中,癌细胞和CD8+ T细胞都在争夺有限的天冬酰胺。这种“营养争夺战”的结果,将直接影响着谁能在这场与癌症的较量中占据上风。
2. 卵形拟杆菌:肠道里的“天冬酰胺消耗者”
研究的焦点聚集在了卵形拟杆菌上。这种细菌在人类肠道中普遍存在。科学家们发现,卵形拟杆菌体内含有一个特殊的bo-ansB基因。这个基因编码了一种特殊的酶,而这种酶的独特之处在于,它能高效地分解天冬酰胺。这意味着,当这种细菌在肠道中活跃时,它会像一个“营养分配官”,大量消耗肠道中的天冬酰胺,从而改变了宿主(也就是我们)可以吸收利用的氨基酸总量。
那么,这种肠道细菌对天冬酰胺的消耗,究竟会对癌症进程产生怎样的影响呢?是会饿死癌细胞,帮助身体抗癌?还是会产生意想不到的“副作用”,反而阻碍免疫系统的抗癌功能呢?接下来的发现,让科学家们既惊讶又深思。
三、惊人发现:肠道菌群如何“好心办坏事”——助癌还是抑癌?
这项研究最引人入胜之处,便是它揭示了肠道菌群与癌症免疫之间一个看似矛盾却又充满逻辑的“营养依赖性免疫调节回路”。科学家们的实验结果,为我们展示了肠道菌群如何通过精确调控天冬酰胺的利用,从而对结直肠癌的进展产生截然不同的影响。
1. bo-ansB基因存在时:CD8+ T细胞的“营养饥荒”
研究人员首先观察到,当卵形拟杆菌体内的bo-ansB基因正常发挥作用时,这些细菌会在肠道中大量分解和消耗天冬酰胺。这导致一个直接后果:能够被肠道吸收进入血液、并最终输送到肿瘤区域的天冬酰胺总量显著减少。从表面上看,这似乎是个好消息,因为癌细胞也需要天冬酰胺来维持生长,减少其供应岂不是能“饿死”肿瘤?
然而,事实却出人意料。研究发现,这种天冬酰胺的减少,对CD8+ T细胞(我们身体最主要的“抗癌杀手”)造成了更严重的打击。原来,这些“免疫勇士”同样对天冬酰胺的供应高度敏感。当天冬酰胺不足时,CD8+ T细胞表面的一个关键氨基酸转运蛋白(名为SLC1A5)的表达会大幅减少。这个转运蛋白就像是CD8+ T细胞吸收天冬酰胺的“大门”,大门紧闭,即便有少量天冬酰胺,也难以进入细胞。
更糟糕的是,缺乏足够的天冬酰胺,会严重损害CD8+ T细胞维持其“干细胞样特性”的能力。所谓“干细胞样特性”,就好比一支军队的“后备兵源和士气”,它决定了T细胞能否在肿瘤环境中持久作战、不断增殖分化出更多的“杀手T细胞”来对抗癌症。一旦这种特性受损,CD8+ T细胞就变得疲惫、功能低下,无法有效地执行杀伤任务。因此,尽管卵形拟杆菌消耗了天冬酰胺,但这种“好心”却意外地“帮了倒忙”,通过“饿坏”免疫细胞,反而促进了肿瘤的进展!
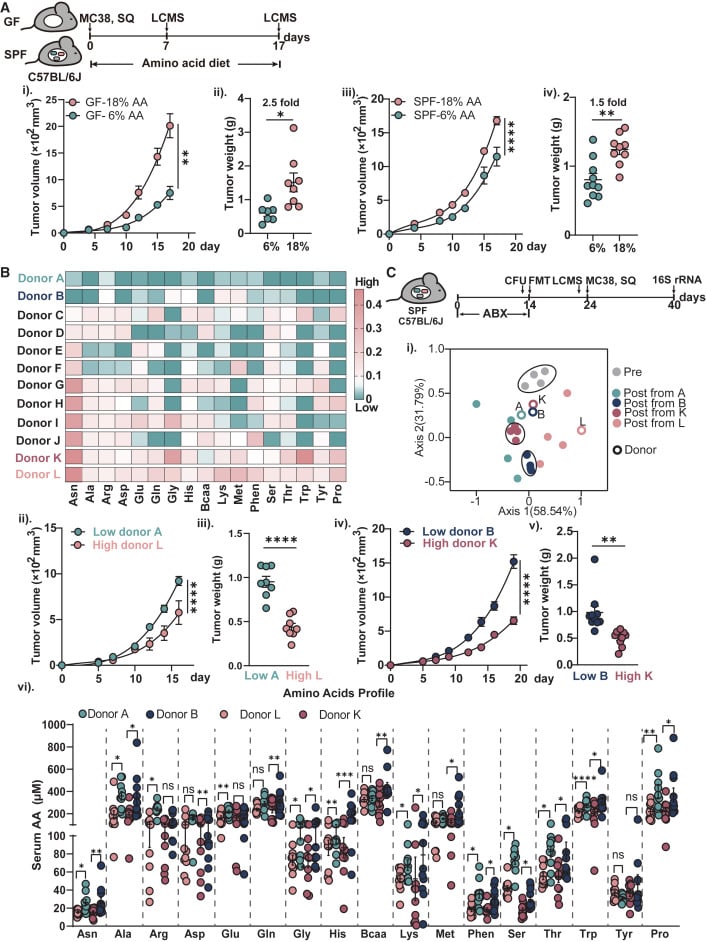
2. 敲除bo-ansB基因后:免疫细胞的“满血复活”
为了进一步验证这一机制,研究人员进行了巧妙的对比实验:他们通过基因工程手段,敲除了卵形拟杆菌体内的bo-ansB基因。结果,情况发生了戏剧性的逆转!
当bo-ansB基因被敲除后,卵形拟杆菌无法再像以前那样大量分解天冬酰胺。这意味着更多的天冬酰胺得以通过肠道屏障,进入血液循环,并最终抵达肿瘤微环境。此时,CD8+ T细胞获得了充足的“补给”,它们的SLC1A5转运蛋白表达上调,能够高效地吸收天冬酰胺。在充足的营养支持下,CD8+ T细胞能够更好地维持其“干细胞样特性”,迅速增殖分化为更多、更强大的“杀手T细胞”,从而更有效地识别和抑制肿瘤的生长。在这里,同一种氨基酸——天冬酰胺,因为肠道细菌代谢能力的微小差异,竟然产生了截然相反的效果:一边是“资敌”(饿坏免疫细胞),一边是“强军”(增强免疫抗癌)。
这项研究的精妙之处在于,它不再是笼统地描述“菌群影响免疫”,而是首次明确指出了一条清晰的因果链:特定的肠道细菌基因(bo-ansB) → 消耗特定的饮食成分(天冬酰胺) → 重塑肿瘤微环境的营养格局 → 精准影响特定免疫细胞(CD8+ T细胞)的功能状态 → 最终改变癌症进程。这一发现,为我们理解肠道菌群与癌症免疫之间的复杂交互作用,打开了全新的视野。
四、从实验室到临床:这项发现对结直肠癌患者意味着什么?
实验室的发现,最终的价值在于能否应用于临床,为患者带来实实在在的益处。这项关于肠道菌群、天冬酰胺和CD8+ T细胞的研究,其意义远超小鼠模型本身,为结直肠癌乃至其他癌症的治疗,提供了革命性的新思路。
1. 人类患者的证据:微生物基因与癌症进展的关联
为了增强研究结果的临床说服力,科学家们进一步将视野投向了人类患者。他们分析了大量结直肠癌患者的肠道微生物基因组数据,并惊喜地发现,在人类患者中,那些编码“氨基酸消耗酶”的微生物基因(类似于小鼠模型中的bo-ansB基因)的丰度,确实与癌症的进展和预后存在显著关联。这意味着,在小鼠模型中揭示的这一精细机制,很可能在人体内也同样有效,甚至发挥着关键作用。
这一发现提醒我们,在抗击癌症时,我们不仅需要密切关注肿瘤本身的生物学特性,更要深入了解体内“微生物盟友”和“敌人”的动态,以及我们每天摄入的食物,是如何被这些微生物转化,进而影响全身抗癌免疫力的。MedFind致力于为患者提供最新、最权威的抗癌资讯,帮助您理解这些复杂而前沿的科学发现,从而更好地与您的主治医生沟通,制定更全面的治疗方案。
2. 癌症治疗新视角:饮食、菌群与免疫的“三角关系”
这项研究的突破性,在于它将饮食、肠道菌群和抗癌免疫这三者紧密联系起来,形成了一个全新的“癌症治疗新视角”:
- 饮食不再仅仅是营养摄入:我们吃进去的食物,不仅直接为身体提供能量,更重要的是,它们为肠道菌群提供了“原材料”,菌群的代谢活动又反过来影响着我们身体的免疫反应。
- 肠道菌群不再是旁观者:它们是活跃的“营养分配官”,能够精准调控关键代谢物质(如天冬酰胺)的水平,从而直接影响免疫细胞的功能。
- 免疫系统可塑性更强:通过干预饮食和肠道菌群,我们有望在不直接针对肿瘤的情况下,间接增强免疫系统对抗癌症的能力,甚至提高传统免疫治疗的效果。
未来,这可能意味着我们能通过更精准的手段,如特定的益生菌补充、饮食干预,甚至“粪菌移植”,来优化患者的肠道微生态,从而为CD8+ T细胞创造一个更有利的“作战环境”,让它们能够更有效地攻击癌细胞。
五、展望未来:个性化饮食与癌症免疫治疗
这项研究为我们描绘了一个激动人心的未来:个性化治疗的时代可能不仅限于基因测序和靶向药物,更将延伸到我们日常的饮食和肠道微生态管理。我们已经看到,同一个氨基酸,在不同的菌群背景下,对癌症的影响可能天差地别。
1. 个体差异的重要性:为何“别人的良药可能是你的毒药”?
研究者强调,继续深入研究饮食、微生物群和免疫系统之间的相互作用至关重要。因为每个人的肠道菌群都是独一无二的,就像指纹一样。这意味着,对于一个人而言能增强免疫系统的特定饮食,对于拥有不同微生物群的另一个人来说,可能效果甚微,甚至适得其反。例如,同样是富含天冬酰胺的食物,在某些肠道菌群构成下可能有助于抗癌免疫,而在另一些菌群构成下则可能被过度消耗,反而抑制免疫。这正是个性化治疗的核心理念。
未来的目标是实现真正的个性化治疗:通过分析患者的肠道菌群构成和代谢能力,量身定制特定的饮食方案,甚至开发新型的“益生菌药物”,使其与个体自身的微生物群协同作用,最大化地增强免疫系统对抗癌症的能力。这不仅能为癌症患者提供新的治疗选择,还能帮助那些对现有免疫疗法不敏感的患者找到新的希望。
2. MedFind与您的抗癌之路:前沿资讯,精准服务
面对如此复杂而前沿的医学研究,作为患者和家属,如何获取可靠信息并将其转化为实际的治疗选择,往往是一大挑战。MedFind正是为此而生。我们不仅致力于分享最新、最权威的抗癌资讯和诊疗指南,更希望能成为您抗癌路上的指路明灯和可靠伙伴。
在MedFind平台,您不仅能了解到像肠道菌群与癌症免疫这类前沿研究的深度解读,还能获取:
- 详细的药物信息:包括国内外已上市及前沿抗癌药物的适应症、疗效数据、副作用管理等。
- 跨境购药渠道协助:对于国内尚未上市的创新药物,我们能协助患者构建安全、便捷的抗癌药品跨境直邮渠道,让您第一时间接触到全球先进的治疗方案。
- AI辅助问诊服务:我们的智能问诊系统能帮助您梳理病情、解答疑问,并推荐可能的治疗方向,让您在复杂的信息中找到清晰的路径。
我们坚信,在与癌症的斗争中,知识就是力量。了解最新的科研进展,结合个体情况,与专业医生共同探讨最适合您的治疗方案,是迈向康复的关键一步。MedFind将始终与您同行,提供专业、温暖、客观的帮助,助您对抗病魔,重获健康。如果您对这项研究,或任何抗癌治疗方案有疑问,欢迎随时咨询我们的专家团队,获取个性化建议。
结语
这项关于肠道菌群、天冬酰胺和癌症免疫的深度研究,无疑为我们打开了一扇通往个性化癌症治疗的新大门。它清晰地表明,我们肠道中的微生物不再是旁观者,而是抗癌战争中的关键参与者。通过理解并干预肠道菌群与氨基酸代谢的微妙交互,我们有望开发出更智能、更精准的治疗策略,让每一位患者都能获得量身定制的抗癌方案。未来,或许通过简单的饮食调整或益生菌补充,就能显著提升免疫治疗的效果,甚至逆转癌症进程。这无疑为全球数以亿计的癌症患者及其家庭带来了新的希望之光。在抗癌的征程上,MedFind将持续关注前沿科学进展,与您携手,共克时艰!