对于无数正在与癌症抗争的患者和家庭而言,每一次医学新发现都承载着生命的希望。在众多血液恶性肿瘤中,多发性骨髓瘤(MM)因其复杂的发病机制和治疗后易复发的特性,始终是医学界面临的重大挑战。尽管近年来免疫治疗,特别是CAR-T细胞疗法和免疫检查点抑制剂(如PD-1/PD-L1抗体),为部分患者带来了曙光,但免疫耐药性问题依然像一道难以逾越的鸿沟,阻碍着治疗效果的长期维持。令人振奋的是,来自浙江大学的何静松、蔡真、林文龙等专家团队在《Advanced Science》期刊上发表了一项突破性研究,首次揭示了一类名为FAPα⁺巨噬细胞的特殊免疫细胞,如何通过双重机制促使多发性骨髓瘤逃避免疫系统的“追杀”。这项研究不仅深入阐明了免疫耐药的潜在根源,更重要的是,它为我们指明了一个极具潜力的新靶点,有望增强现有PD-1/PD-L1抗体疗法的效果,为多发性骨髓瘤患者克服治疗瓶颈、重燃生命希望带来了新的可能。
多发性骨髓瘤:一场复杂且持续的“战役”
多发性骨髓瘤是什么?
多发性骨髓瘤(Multiple Myeloma, 简称MM)是一种起源于浆细胞的血液系统恶性肿瘤。浆细胞是人体免疫系统中一种重要的白细胞,主要负责产生抗体来对抗感染。然而,在多发性骨髓瘤患者体内,这些浆细胞发生了恶性变异,在骨髓中异常增殖,形成克隆性浆细胞。这些异常浆细胞不仅无法正常工作,还会分泌大量单克隆免疫球蛋白(M蛋白),并对骨髓微环境造成破坏,导致一系列严重的临床症状。
- 骨骼破坏: 异常浆细胞会激活破骨细胞,抑制成骨细胞,导致骨骼溶解、骨痛、骨质疏松、病理性骨折,甚至脊髓压迫。这是MM患者最常见和痛苦的症状之一。
- 贫血: 骨髓是造血工厂,异常浆细胞的过度增殖会挤占正常造血空间,导致红细胞、白细胞和血小板生成减少,引起贫血、感染风险增加和出血倾向。
- 肾功能不全: 大量M蛋白会在肾小管中沉积,损害肾脏功能,导致肾功能不全。
- 高钙血症: 骨骼破坏释放大量钙质进入血液,引起高钙血症,表现为疲乏、恶心、便秘、意识模糊等。
全球范围内,多发性骨髓瘤的发病率呈现上升趋势,尤其多见于老年人群。它是一种慢性且难以治愈的疾病,患者往往需要长期治疗。
现有治疗方案与困境
在过去的几十年里,多发性骨髓瘤的治疗取得了显著进展,从传统的化疗发展到靶向治疗和免疫疗法,极大地改善了患者的生存期和生活质量。
- 传统治疗: 主要包括蛋白酶体抑制剂(PI,如硼替佐米、卡非佐米)和免疫调节药物(IMiDs,如来那度胺、泊马度胺)。这些药物通过干扰癌细胞的生存通路来发挥作用。
- 创新疗法: 近年来,嵌合抗原受体T(CAR-T)细胞疗法在多发性骨髓瘤治疗中展现出革命性的前景,通过改造患者自身的T细胞使其能特异性识别并攻击癌细胞。它为部分难治性或复发性患者带来了长期缓解的希望。然而,仍有相当比例的患者最终对CAR-T细胞疗法产生耐药性,疾病复发,严重限制了其长期疗效。
- 免疫检查点抑制剂(ICI): PD-1/PD-L1抗体是另一种广受关注的免疫疗法,通过阻断PD-1/PD-L1通路,解除免疫细胞的“刹车”,重新激活T细胞对肿瘤的攻击。这类药物在多种实体肿瘤(如肺癌、黑色素瘤)中取得了显著成功。然而,令人遗憾的是,PD-1/PD-L1抗体在多发性骨髓瘤等血液恶性肿瘤中的疗效却显著低于预期,这使得科学家们不得不深入探究其背后的原因。
尽管这些治疗手段层出不穷,但治疗耐药性和疾病复发仍然是多发性骨髓瘤治疗中的主要瓶颈。如何克服免疫治疗的耐药性,寻找新的治疗靶点,成为了当前研究的焦点。
免疫逃逸:肿瘤为何能躲过“追杀”?
肿瘤免疫微环境(TME)的核心角色
肿瘤的生长和发展并非孤立进行,而是与周围环境密切互动。这个复杂的“生态系统”被称为肿瘤免疫微环境(Tumor Microenvironment, TME),它由肿瘤细胞本身、各种免疫细胞(如T细胞、B细胞、巨噬细胞、树突状细胞等)、基质细胞(如成纤维细胞)、血管、淋巴管以及多种可溶性因子组成。TME在肿瘤的发生、发展、转移以及对治疗的反应中都扮演着至关重要的角色。
在多发性骨髓瘤中,骨髓微环境(BMME)更是疾病进展的关键。恶性浆细胞在骨髓中与骨髓基质细胞、免疫细胞等相互作用,形成一个有利于肿瘤生长和免疫抑制的环境,从而帮助肿瘤细胞逃避免疫系统的识别和清除。
免疫检查点PD-1/PD-L1的免疫抑制作用
免疫检查点分子是免疫系统中的“刹车”或“开关”,它们在正常情况下用于维持免疫平衡,防止免疫系统过度激活攻击自身组织。PD-1(程序性死亡受体1)及其配体PD-L1(程序性死亡配体1)是其中最重要的一对。
- PD-1: 主要表达在T细胞(免疫系统的“战士”)表面。当T细胞识别到肿瘤细胞时,理论上会发动攻击。
- PD-L1: 可以表达在肿瘤细胞表面,也可以表达在肿瘤微环境中的其他细胞(如巨噬细胞)表面。
当PD-1与PD-L1结合时,会向T细胞发出“停止攻击”的信号,从而抑制T细胞的活性,使肿瘤细胞得以安全逃脱免疫监视。肿瘤细胞非常“狡猾”,它们会通过各种机制上调自身或周围细胞的PD-L1表达,像披上了一层“隐身衣”,或给T细胞喂下了“麻醉剂”,使其无法有效识别并杀死肿瘤。
血液肿瘤(MM)免疫治疗的特殊性
尽管PD-1/PD-L1抗体在实体瘤中大放异彩,但在多发性骨髓瘤等血液恶性肿瘤中的效果却不尽如人意。这引发了科学家们的深入思考:究竟是什么原因导致了这种差异?有研究指出,在多发性骨髓瘤的TME中,可能存在其他强效的免疫抑制机制,或者PD-L1的表达模式和调控方式与实体瘤有所不同。例如,近期有研究显示,经基因工程改造实现PD-1下调的CAR-T细胞,在MM中表现出更强的抗肿瘤活性,这暗示了PD-1/PD-L1通路在MM中的抑制作用仍然非常关键,但可能需要更深层次的干预。
以往,人们更多关注肿瘤细胞本身PD-L1的表达。然而,越来越多的证据表明,在肿瘤微环境中的免疫细胞(如巨噬细胞)表面表达的PD-L1,在介导肿瘤免疫逃逸中也起着主导作用,尽管这一过程背后的具体分子机制仍然很大程度上难以捉摸。
浙江大学重大发现:FAPα⁺巨噬细胞,免疫逃逸的“幕后黑手”
正是在这样的背景下,浙江大学何静松、蔡真、林文龙团队的最新研究成果,为我们揭示了多发性骨髓瘤免疫逃逸的一个重要“幕后黑手”——FAPα⁺巨噬细胞。
什么是FAPα⁺巨噬细胞?
巨噬细胞是TME中一种非常重要的免疫细胞,它们具有极高的可塑性,可以根据微环境信号分化为不同的功能亚群,发挥促肿瘤或抑肿瘤的作用。传统的分类将巨噬细胞分为M1型(抗肿瘤)和M2型(促肿瘤)。然而,随着研究深入,科学家们发现巨噬细胞的异质性远超M1/M2模式,存在更多独特的亚群。
FAPα(成纤维细胞活化蛋白α)是一种跨膜蛋白酶,长期以来被认为是活化成纤维细胞(尤其是癌症相关成纤维细胞,CAFs)的经典生物标志物。CAFs被已知在肿瘤微环境中促进肿瘤进展、转移和化疗耐药,甚至削弱CAR-T细胞治疗的疗效。然而,FAPα除了在成纤维细胞中的作用外,是否在其他免疫细胞中也有表达?其在多发性骨髓瘤中的作用机制又是怎样的?这些问题一直未被充分阐明。
浙江大学团队的创新之处在于,他们首次在多发性骨髓瘤患者的肿瘤微环境中,鉴定出一类高表达FAPα的巨噬细胞亚群,并将其命名为FAPα⁺巨噬细胞。这一发现打破了FAPα仅限于成纤维细胞的传统认知,揭示了巨噬细胞异质性中一个此前未被充分认识的成员。
FAPα⁺巨噬细胞的“藏身之处”与“活跃程度”
这项研究通过严谨的临床分析发现:
- 高度富集于骨髓: 多发性骨髓瘤患者骨髓中的FAPα⁺巨噬细胞富集程度显著高于外周血。这表明FAPα⁺巨噬细胞是骨髓微环境中的一个重要组成部分,可能与骨髓中的肿瘤生长和免疫抑制密切相关。
- 与肿瘤负荷正相关: FAPα⁺巨噬细胞的丰度与患者的肿瘤负荷呈正相关,即肿瘤越严重的患者,其骨髓中FAPα⁺巨噬细胞的数量越多。这进一步提示了这类细胞在肿瘤进展中的关键作用。
- 在骨髓微环境中的主导地位: 研究还发现,在多发性骨髓瘤的骨髓微环境中,FAPα⁺巨噬细胞的细胞占比甚至高于FAPα⁺骨髓基质细胞(BMSCs),这强调了其作为免疫抑制性细胞的主导地位。
这些临床数据为FAPα⁺巨噬细胞在多发性骨髓瘤免疫逃逸中的重要作用提供了坚实基础。
双重机制揭秘:FAPα⁺巨噬细胞如何“助纣为虐”?
FAPα⁺巨噬细胞究竟是如何帮助多发性骨髓瘤细胞逃避免疫攻击的呢?浙江大学团队深入探究了其背后的分子机制,揭示了其通过“双重调控”来主导免疫抑制的精巧策略。
机制一:稳定PD-L1表达,持续“麻痹”免疫细胞
FAPα⁺巨噬细胞的首个“诡计”是确保PD-L1蛋白在肿瘤微环境中的高表达和稳定性,从而持续对T细胞施加“麻痹”效应。
- N-糖基化修饰与抑制降解: 研究发现,FAPα能够通过维持PD-L1蛋白的N-糖基化修饰,并抑制其被蛋白酶体降解。这就像FAPα给PD-L1穿上了一层“防护服”,使其不易被清除,从而大大延长了PD-L1在细胞表面的“寿命”。PD-L1持续存在,就能持续结合T细胞上的PD-1,不断发出“停止攻击”的信号。
- 促进PD-L1合成: 更进一步,FAPα还能通过与波形蛋白(VIM)相互作用,并促进波形蛋白S72位点的磷酸化,进而诱导PD-L1的合成。这相当于FAPα不仅保护了已有的PD-L1,还充当了PD-L1的“生产线管理员”,源源不断地生产出新的PD-L1分子。
综合来看,FAPα就像一个“保护罩”和“生产线”,确保PD-L1在肿瘤细胞或巨噬细胞表面大量存在,持续关闭免疫细胞的攻击,使肿瘤得以肆无忌惮地生长。
机制二:加速T细胞衰老,让“战士”失去战斗力
除了稳定PD-L1,FAPα⁺巨噬细胞还有另一个更阴险的手段——直接削弱免疫系统的“主力军”T细胞的战斗力,使其陷入“衰老”状态。
- 分泌可溶性FAPα: 研究发现,FAPα⁺巨噬细胞可以通过分泌可溶性FAPα蛋白。这种可溶性FAPα并不停留在巨噬细胞表面,而是释放到肿瘤微环境中,像一个“毒素”一样扩散开来。
- 加速T细胞衰老: 当T细胞暴露在可溶性FAPα的作用下,其衰老过程被显著加速。T细胞衰老意味着它们的功能受损,无法有效识别和清除肿瘤细胞,即使它们“看到了”肿瘤,也力不从心。令人担忧的是,这种由FAPα诱导的T细胞衰老效应,无法通过单独使用PD-1/PD-L1抗体疗法来逆转,这解释了为什么传统PD-1/PD-L1抗体在MM中效果不佳的原因之一。
- 临床印证: 对复发/难治性多发性骨髓瘤(RRMM)患者的骨髓样本分析发现,这些患者体内的双阴性T细胞(DNTs,一种功能受损的T细胞亚群)比例升高,同时T细胞分泌的颗粒酶B(GZMB,一种杀死肿瘤细胞的效应分子)水平降低。这些临床发现进一步印证了FAPα⁺巨噬细胞确实在加速T细胞衰老,使其失去抗肿瘤功能。

未来展望:靶向FAPα⁺巨噬细胞,打破免疫抑制,重燃抗癌希望
清除FAPα⁺巨噬细胞:免疫治疗的“神助攻”
这项研究最令人兴奋的临床意义在于,它为克服多发性骨髓瘤免疫治疗耐药提供了一个全新的策略。如果FAPα⁺巨噬细胞是免疫逃逸的关键“帮凶”,那么清除它们,或者抑制FAPα的功能,是否就能增强免疫治疗的效果呢?
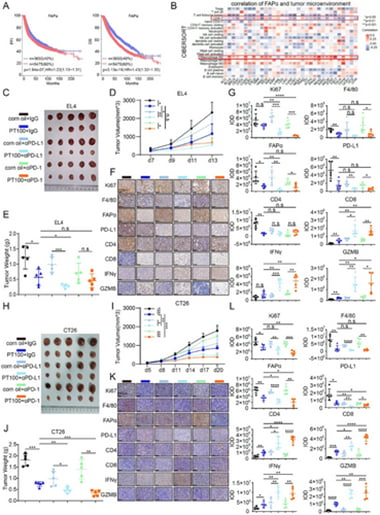
研究团队在多发性骨髓瘤小鼠模型中进行了验证,结果令人鼓舞:
- 显著提升PD-1/PD-L1抗体疗效: 在MM小鼠模型中,清除FAPα⁺巨噬细胞可以显著提升PD-1/PD-L1抗体疗法的效果,肿瘤生长得到更有效的控制。这表明,FAPα⁺巨噬细胞确实是限制PD-1/PD-L1抗体疗效的关键因素。
- 更广泛的抗肿瘤效果: 这种联合策略(FAPα⁺巨噬细胞阻断疗法联合PD-1/PD-L1抗体)不仅在多发性骨髓瘤中有效,在EL4淋巴瘤和CT26结直肠癌等其他肿瘤模型中也展现出增强的抗肿瘤效果。这提示了靶向FAPα⁺巨噬细胞可能具有更广泛的抗肿瘤潜力,未来有望应用于多种肿瘤类型。
然而,研究也指出,对反CTLA-4疗法(另一种免疫检查点抑制剂)无明显增效作用,这说明FAPα⁺巨噬细胞的免疫抑制机制可能更特异性地与PD-1/PD-L1通路相关联。
FAPα:一个极具潜力的治疗靶点
综上所述,浙江大学的这项研究通过详细的机制分析和动物模型验证,明确证实了FAPα⁺巨噬细胞通过稳定PD-L1表达和加速T细胞衰老这两种独立且协同的机制,驱动多发性骨髓瘤的免疫逃逸。这一发现不仅深入揭示了多发性骨髓瘤免疫耐药的复杂性,更重要的是,它将FAPα⁺巨噬细胞推向了聚光灯下,使其成为一个极具潜力的治疗靶点。
未来,针对FAPα⁺巨噬细胞的靶向药物或疗法(例如,开发特异性清除FAPα⁺巨噬细胞的药物,或抑制FAPα功能的药物)与现有PD-1/PD-L1抗体疗法进行联合应用,有望打破多发性骨髓瘤的免疫抑制微环境,解除T细胞的“束缚”,重新激活其抗肿瘤活性,从而显著提升治疗应答率和长期生存获益。这项研究为克服多发性骨髓瘤的治疗瓶颈,为患者带来更有效、更持久的治疗方案,提供了坚实的理论基础和新的方向。
MedFind温馨提示:把握前沿,共抗癌魔
浙江大学团队的这项研究成果,无疑为多发性骨髓瘤的治疗策略带来了新的希望和方向。它提醒我们,在复杂的抗癌道路上,每一次对疾病机制的深入探索,都可能解锁新的治疗突破口。对于多发性骨髓瘤患者和家属而言,了解这些前沿进展,意味着面对疾病将有更多的选择和信心。
MedFind始终致力于为广大癌症患者及家属提供全球最新、最准确的抗癌资讯、诊疗指南和药物信息。我们深知您在面对疾病时的焦虑与无助,因此我们努力将复杂的医学研究转化为通俗易懂的科普内容,帮助您更好地理解病情、把握治疗机会。
如果您对多发性骨髓瘤的最新治疗方案、前沿药物、副作用管理有疑问,或正在寻找国内外已上市的创新药物(例如PD-1/PD-L1抑制剂),并希望了解跨境购药渠道与价格,MedFind将是您值得信赖的伙伴。我们提供专业的AI辅助问诊服务,解答您的困惑;更重要的是,我们能够协助您构建安全的抗癌药品跨境直邮渠道,让您不再错过任何可能带来希望的治疗机会。请记住,在抗癌的道路上,您不是一个人在战斗。携手MedFind,我们共同关注医学前沿,一起为生命而战!