肿瘤治疗中的数字迷思:为何标准和测量如此复杂?
在癌症,尤其是卵巢癌的治疗旅程中,患者和家属经常会接触到大量看似精确的数字和测量指标。这些数字可能来自临床试验的入组标准、预后生存期的统计数据,或是手术报告中对残余病灶大小的描述。它们是肿瘤学研究和临床实践的基石,但其解读的复杂性往往被忽视。本文旨在深入剖析这些关键数字背后的真实临床意义和局限性,帮助卵巢癌患者及其家属避免盲目遵循数字,从而做出更优化的治疗决策。
肿瘤学中的数字,无论是代表治疗线数、生存时间,还是肿瘤尺寸,其本质都是为了在群体层面实现科学的量化和比较。然而,个体患者的病情具有高度异质性,这意味着群体统计数据和严格的试验标准,在应用于具体患者时,必须经过审慎的个体化评估。盲目地将这些数字视为绝对的“门槛”或“判决”,可能会限制患者获得最佳治疗的机会。
第一重数字迷思:临床试验的“既往治疗线数”限制
在针对复发性或难治性癌症(如铂类耐药卵巢癌)的临床试验中,研究人员通常会严格限制患者既往接受的治疗方案数量(即“治疗线数”)。例如,某项试验可能规定患者最多只能接受过两次既往治疗。这种限制的目的是为了确保研究人群的同质性,从而更准确地评估新药的疗效和安全性。然而,这种科学上的必要性,在临床实践中却可能引发矛盾。
铂类耐药的精确界定:PFI的“6个月”门槛
在卵巢癌的治疗中,“铂类耐药”和“铂类敏感”是决定后续治疗策略的关键概念。这通常是通过“铂类无间隔期”(Platinum-Free Interval, PFI)来定义的。PFI 是指患者完成上一次含铂化疗后,到疾病再次进展或复发之间的时间。国际上普遍接受的标准是:
- 铂类敏感(Platinum-Sensitive): PFI ≥ 6个月。这类患者通常对再次使用含铂方案仍有较好的反应。
- 铂类耐药(Platinum-Resistant): PFI < 6个月。这类患者对含铂方案的反应率显著降低,需要考虑非铂类化疗、靶向治疗或免疫治疗等创新方案。
然而,正如原始文章所指出的,一名患者可能在疾病早期对多次含铂方案都有良好反应,且每次复发间隔都超过一年,但在被宣布为“耐药”后,她可能已经接受了多于试验规定的治疗线数。那么,这位患者对新的试验药物的反应,会比那些在单次含铂治疗后就迅速进展的患者更差吗?科学证据表明,答案很可能是否定的。
既往治疗线数的限制:平衡疗效与毒性的考量
临床试验设置治疗线数限制,主要基于两个核心考量:
- 科学同质性: 确保参与试验的患者在疾病阶段和治疗背景上尽可能相似,以减少混杂因素对疗效评估的影响。
- 安全性考量: 接受过多线治疗的患者,其正常器官功能(尤其是骨髓储备、肾功能和神经系统)往往受到累积性损伤。例如,多次使用紫杉醇或铂类药物会显著增加周围神经毒性的风险。限制治疗线数是为了避免在试验中出现不可接受的过度毒性。
因此,对于那些既往治疗线数较多的患者,虽然其肿瘤对新药的敏感性可能并未降低,但其承受药物副作用的能力却可能显著下降。这提醒我们,在评估治疗方案时,毒性风险的累积效应是比单纯的治疗线数数字更重要的考量因素。
试验限制与真实世界治疗的差异
临床试验的严格入组标准是科学研究的必要条件,但这些标准不应成为临床治疗的绝对障碍。在真实世界的临床实践中,如果一位卵巢癌患者的身体状况良好,且有证据表明她可能从某一创新疗法中获益,医生不应仅仅因为她超过了试验规定的“2线”或“3线”治疗限制而拒绝该方案。医生需要进行个体化的风险-获益评估。
对于面临治疗线数限制或标准治疗方案受限的患者,了解国际前沿的治疗选择至关重要。MedFind 提供权威的药物信息、治疗方案解读、临床研究与指南资讯,帮助患者及时了解前沿进展,并可通过专业渠道了解抗癌药品代购与国际直邮服务,获取急需的海外药物,以确保治疗方案不被国内的审批进度或临床试验的数字门槛所限制。
第二重数字迷思:生存期和预后的统计学陷阱
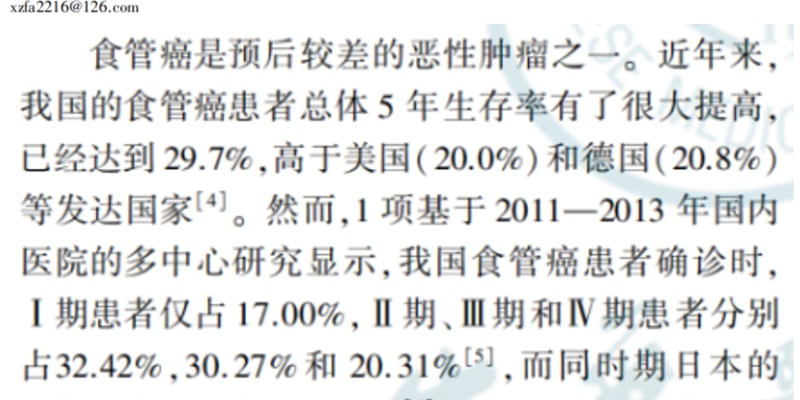
癌症患者及其家属最关心的问题之一是“我还能活多久?”肿瘤医生通常会提供基于统计数据的预后信息,例如“5年生存率”。然而,这些数字的解读充满挑战,因为它们往往是静态的、基于初始诊断时的数据,并不能反映患者在成功完成治疗后,随着时间推移预后发生的积极变化。
初始诊断预后的局限性:5年生存率的误读
“5年生存率”是指在某一特定癌症阶段被诊断的患者,在诊断后五年仍然存活的百分比。虽然这是衡量治疗进步的重要指标,但它存在严重的局限性:
- 数据滞后性: 统计数据通常基于几年前甚至十几年前的治疗结果。随着医学的进步,今天的治疗效果往往远优于统计数据所反映的情况。
- 群体而非个体: 5年生存率是一个群体统计概念,它无法预测任何个体患者的命运。它代表的是一个连续体,患者可能处于这个连续体的任何位置。
- 时间依赖性: 5年生存率只反映了从诊断时算起的生存概率。对于已经成功度过两年治疗期的患者来说,这个数字已经不再具有完全的参考价值。
动态评估预后:条件生存期(Conditional Survival)的价值
为了克服静态预后数据的局限性,研究人员开始关注“条件生存期”(Conditional Survival, CS)分析。条件生存期回答的是一个更具临床意义的问题:“如果患者已经成功存活了 X 年,那么她再存活 Y 年的概率是多少?”
例如,一位被诊断为 III 期卵巢癌的患者,其初始诊断的 5 年生存率可能是 40%。但如果这位患者在成功完成手术和化疗后,已经无瘤生存了 2 年,那么她从现在算起再活 3 年(即总共存活 5 年)的概率,将远高于初始的 40%。条件生存期分析表明,随着患者存活时间的延长,他们的预后会显著改善,因为他们已经成功跨越了早期复发的高风险期。
对于患者而言,了解条件生存期数据至关重要。它能提供更积极、更现实的预后评估,帮助患者和家属在长期抗癌过程中保持希望和动力。肿瘤医生有责任向患者解释这些数据的动态变化,而不是仅仅依赖初始诊断时的统计数字。
预后讨论的艺术:统计学与个体化
在讨论预后时,医生需要强调统计数据的本质,并结合患者的具体情况进行个体化评估。这包括:
- 肿瘤的生物学特性(如分子分型、突变状态)。
- 患者对既往治疗的反应(如缓解深度和持续时间)。
- 患者的身体机能状态(PS评分)。
患者应主动与医生沟通,询问最新的、基于治疗进展后的预后数据,并理解预后是一个动态变化的过程。通过AI辅助问诊服务,患者可以更系统地整理自己的病情信息和疑问,提高与医生沟通的效率和深度。
第三重数字迷思:手术残余病灶的“1厘米”标准
在卵巢癌的治疗中,细胞减灭术(Cytoreductive Surgery)是决定预后的最关键因素之一。手术的目标是尽可能切除所有可见的肿瘤病灶,以达到“满意减瘤”或“最佳减瘤”状态。而这个“满意”的标准,长期以来被量化为一个具体的数字:残余病灶的最大直径不超过 1 厘米。
细胞减灭术的核心目标:追求R0切除
现代肿瘤外科追求的目标是 R0 切除,即肉眼和显微镜下均无残余病灶。然而,对于广泛转移的 III/IV 期卵巢癌,完全 R0 切除往往难以实现。因此,临床上将残余病灶的大小作为衡量手术质量的关键指标:
- R0(完全切除): 无肉眼可见残余病灶。
- R1(镜下残余): 肉眼无残余,但切缘显微镜下有癌细胞。
- R2(肉眼残余): 存在肉眼可见的残余病灶。
在 R2 的情况下,残余病灶的大小直接影响患者的生存期。残余病灶越小,患者的预后越好。因此,将“最大残余病灶直径 < 1 cm”作为“满意减瘤”的标准被广泛采纳。
“1厘米”标准的由来与实践中的荒谬
“1厘米”这个数字并非基于精确的生物学阈值,而更多是基于早期临床试验和观察性研究的结果,它代表了外科医生在当时技术条件下能够达到的一个重要目标。然而,正如原始文章所揭示的,在临床实践中,精确测量腹腔内所有残余病灶的直径,并确保没有一个超过 1 厘米,几乎是不现实的。
腹腔内可能存在数量众多的微小病灶,外科医生需要花费大量时间去测量每一个病灶。原文中提到,一些外科医生为了让患者符合特定临床试验(如腹腔内化疗试验)的入组标准,会记录“0.99 cm”作为最大残余肿瘤直径。这种现象凸显了数字量化在复杂临床环境中的局限性和荒谬性。
这并非否定“1厘米”标准的重要性,而是强调:手术质量的真正价值在于外科医生的经验、技巧和对 R0 切除的追求,而不是对一个精确数字的机械遵守。 对于患者而言,选择经验丰富、技术精湛的妇科肿瘤外科医生,比纠结于手术报告上的精确数字更为重要。
减瘤手术质量对后续治疗方案的影响
残余病灶的大小不仅影响预后,也直接决定了后续治疗方案的选择。例如,历史上一些腹腔内化疗(Intraperitoneal Chemotherapy)的方案,严格要求残余病灶直径小于 1 厘米,因为药物在腹腔内的渗透能力有限。如果残余病灶过大,腹腔化疗的疗效将大打折扣。
此外,手术质量也影响了后续靶向治疗(如PARP抑制剂)的启动时机和效果。因此,患者在术前应充分了解手术目标,并在术后与医生讨论残余病灶情况,以便制定最合适的辅助治疗或维持治疗方案。
跨越数字障碍:患者如何寻求最佳治疗策略?
肿瘤学中的数字是重要的参考工具,但它们绝非决定个体命运的最终判决。对于卵巢癌患者而言,理解这些数字的复杂性和局限性,是做出明智治疗选择的第一步。
充分利用信息资源:解读临床研究与指南
患者需要从权威渠道获取最新的治疗信息。临床研究数据(如无进展生存期PFS、总生存期OS)是评估药物疗效的关键,但患者需要理解这些数据是如何在特定人群(如既往治疗线数受限的患者)中获得的。MedFind 致力于提供最新的药物信息、治疗方案解读、临床研究与指南资讯,帮助患者及时掌握全球抗癌前沿进展。
例如,针对铂类耐药的复发性卵巢癌,国际指南推荐的治疗选择包括:
- 靶向药物: 如贝伐珠单抗联合化疗,或在特定基因突变(如BRCA突变)情况下使用的PARP抑制剂(如奥拉帕利、尼拉帕利)。
- 新型化疗药物: 如脂质体阿霉素、吉西他滨等非铂类方案。
- 临床试验: 探索新的免疫疗法或ADC药物。
患者应关注这些方案在不同治疗线数和PFI长度下的真实疗效数据,而非仅仅被试验的入组数字所限制。
面对耐药与复发:海外新药与创新方案的选择
当患者在国内面临治疗选择受限(例如,既往治疗线数过多、国内尚未批准特定靶向药适应症)时,海外的创新药物和治疗方案往往能带来新的希望。例如,针对特定分子靶点的创新药物可能在海外已经上市或进入后期临床试验。
患者可以通过专业渠道了解抗癌药品代购与国际直邮服务,获取急需的海外药物,确保治疗方案不被国内的审批进度或临床试验的数字门槛所限制。在考虑海外用药时,患者应咨询专业的医学顾问,评估药物的真实疗效数据、副作用和获取渠道,确保安全合规。
医患沟通的关键:超越数字的个体化评估
最终的治疗决策必须是高度个体化的。患者应与医生进行深入沟通,将自身的身体状况、既往治疗反应、生活质量需求等非量化因素纳入决策考量。例如:
- 如果患者的骨髓储备已经很低,即使试验允许,也应谨慎选择高毒性的化疗方案。
- 如果患者对神经毒性非常敏感,应优先选择神经毒性较低的药物。
- 对于预后讨论,患者应要求医生提供基于“条件生存期”的动态评估,而非仅仅是初始诊断时的静态数据。
肿瘤学中的数字是指导我们前进的工具,但它们不应成为限制个体化治疗的枷锁。通过理解这些数字的复杂性,患者和家属可以更积极地参与到治疗决策中,争取最佳的生存和生活质量。
总结:数字是工具,而非治疗的终点
在肿瘤治疗的复杂世界中,数字和测量指标扮演着不可或缺的角色,它们帮助科学家设计严谨的临床试验,指导医生评估预后,并量化手术的质量。然而,正如本文所探讨的,无论是临床试验的入组限制、预后生存期的统计,还是手术残余病灶的测量,这些数字都存在其内在的局限性。
对于卵巢癌患者而言,最重要的是认识到:
- 临床试验的数字限制是为了科学研究的同质性,而非临床治疗的绝对标准。 医生应根据个体患者的毒性耐受度和潜在获益,灵活制定方案。
- 预后数字是统计学概念,而非命运的预言。 随着治疗的成功,患者的实际预后会动态改善,条件生存期提供了更乐观的视角。
- 手术质量的关键在于外科医生的经验和对R0切除的追求,而非对精确“1厘米”数字的机械记录。
通过深入理解这些数字背后的临床意义,患者可以避免被表面的数字所困扰,积极寻求多学科协作和国际前沿的治疗方案,最终实现以患者为中心的最佳治疗效果。如果您需要进一步了解最新的治疗方案或海外药物获取渠道,建议寻求专业的医学咨询服务。