结直肠癌(CRC)分子机制新进展:INHBA的双重致癌作用深度解析
结直肠癌(Colorectal Cancer, CRC)是全球范围内发病率和死亡率最高的恶性肿瘤之一。尽管近年来在手术、化疗、靶向治疗和免疫治疗方面取得了显著进步,但晚期或转移性CRC患者的长期预后仍然不理想。因此,深入探索CRC的分子机制,寻找新的治疗靶点,对于改善患者生存至关重要。
近期,中南大学袁霞和周艳宏团队在权威期刊《Signal Transduction and Targeted Therapy》上发表了一项重要研究,首次系统揭示了蛋白Inhibin beta A(INHBA)在结直肠癌进展中的关键作用。研究发现,INHBA表达升高与患者不良临床结果密切相关,它通过“重塑肿瘤免疫微环境”和“拮抗细胞铁死亡”这两种机制,共同驱动CRC的恶性生长。这一发现不仅为我们理解CRC的复杂性提供了新的视角,也为未来开发针对INHBA的新型抑制剂或联合免疫铁死亡治疗策略奠定了理论基础。
理解肿瘤微环境(TME)与癌症进展
癌症的发生和发展并非仅仅是癌细胞自身的问题,它与周围的“土壤”——肿瘤微环境(TME)息息相关。TME由非恶性细胞(如免疫细胞、成纤维细胞、血管细胞)、细胞外基质以及各种生物活性因子组成。癌细胞与TME之间的持续相互作用,是肿瘤发生、进展和转移的关键驱动力。
肿瘤相关巨噬细胞(TAMs):TME中的关键角色
在TME中,肿瘤相关巨噬细胞(Tumor-Associated Macrophages, TAMs)是数量最多、影响最大的免疫细胞之一。TAMs通常被分为两种主要亚型:
- M1型巨噬细胞:通常被认为是“抗肿瘤”的,能够吞噬癌细胞并释放促炎因子,帮助清除肿瘤。
- M2型巨噬细胞:通常被认为是“促肿瘤”的,它们促进肿瘤免疫抑制、血管生成、组织修复和侵袭性生长。在许多恶性肿瘤中,M2型TAMs的比例升高,预示着更差的预后。
本研究发现,INHBA的一个核心功能就是将TAMs重编程为促肿瘤的M2表型,从而为CRC细胞的生长和转移创造有利条件。
INHBA驱动CRC恶性进展的“双重机制”
INHBA属于转化生长因子-β (TGF-β) 超家族,最初因其在生殖系统中的调控作用而闻名。然而,近年来研究表明,INHBA在多种肿瘤中表达上调,并参与肿瘤进展。中南大学的这项研究详细揭示了INHBA在CRC中的两条关键致癌通路。
机制一:通过琥珀酸/SUCNR1轴促进M2巨噬细胞极化
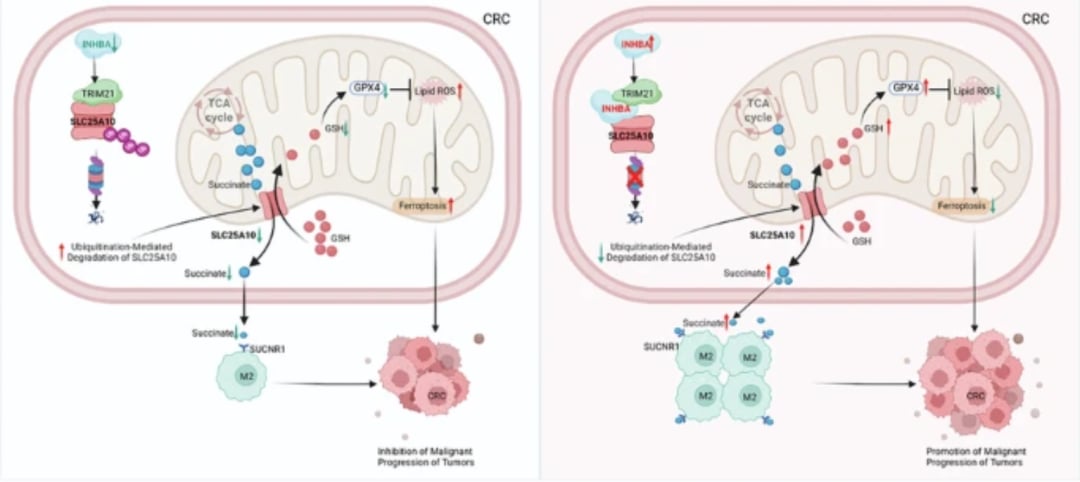
研究人员发现,INHBA通过上调溶质载体家族25成员10(SLC25A10)的表达,激活了琥珀酸/SUCNR1轴,从而促进M2样TAM极化。
- SLC25A10的作用:SLC25A10,又称线粒体二羧酸离子载体(DIC),是一种线粒体转运蛋白。它负责将线粒体代谢产物——琥珀酸盐(Succinate)从线粒体基质转运到细胞质中。
- 琥珀酸盐与SUCNR1:琥珀酸盐是一种重要的循环代谢物。当它被SLC25A10转运到细胞外后,可以作为信号分子激活巨噬细胞表面的琥珀酸受体(SUCNR1,也称GPR91)。
- M2极化:
- 肿瘤细胞来源的琥珀酸盐激活巨噬细胞上的SUCNR1后,会触发一系列信号级联反应,最终导致巨噬细胞向M2型极化,增强肿瘤的免疫逃逸和生长能力。
机制二:激活mtGSH/GPX4途径,抑制线粒体依赖性铁死亡
除了重塑免疫微环境,INHBA还直接干预了癌细胞的死亡程序——铁死亡(Ferroptosis)。
什么是铁死亡?
铁死亡是一种程序性细胞死亡方式,其特征是铁依赖性的脂质过氧化物积累,最终导致细胞膜损伤和细胞死亡。对于癌症治疗而言,诱导癌细胞发生铁死亡是一种极具潜力的治疗策略。许多癌细胞,尤其是那些对传统疗法耐药的癌细胞,往往会发展出抑制铁死亡的能力。
- mtGSH/GPX4轴:谷胱甘肽过氧化物酶4(GPX4)是抵抗铁死亡的关键酶。它利用线粒体谷胱甘肽(mtGSH)来清除有毒的脂质过氧化物,保护细胞免受氧化应激损伤。
- INHBA的干预:研究发现,INHBA能够激活mtGSH/GPX4轴。通过提高GPX4的活性和线粒体GSH的水平,INHBA有效地抑制了CRC细胞中线粒体依赖性的铁死亡,使得癌细胞能够逃脱这种重要的死亡机制,持续增殖。
INHBA通过这两种机制——对外环境的免疫调节和对内环境的细胞死亡抑制——共同推动了结直肠癌的恶性进程。

INHBA稳定SLC25A10的分子细节
为了进一步探究INHBA如何实现上述功能,研究深入分析了其与关键蛋白SLC25A10之间的相互作用。
- TRIM21的作用:三方基序包含蛋白21(TRIM21)是一种E3泛素连接酶,通常通过催化泛素化来标记和降解目标蛋白。研究发现,TRIM21负责介导SLC25A10的泛素化和降解。
- INHBA作为支架蛋白:INHBA在这一过程中扮演了“支架蛋白”的角色。它能够与TRIM21和SLC25A10同时结合,并抑制TRIM21介导的K48连锁泛素化,从而阻止SLC25A10被降解。
- 结果:通过稳定SLC25A10蛋白,INHBA确保了琥珀酸盐的持续外排(促进M2极化)和mtGSH的充足供应(抑制铁死亡),最终增强了CRC细胞的生存优势。
临床意义与未来治疗策略展望
这项研究不仅全面揭示了INHBA在结直肠癌进展中的复杂分子机制,更重要的是,它为CRC的治疗提供了两个极具吸引力的新靶点和联合治疗方向。
1. INHBA作为预后生物标志物
由于INHBA的表达水平与CRC患者的不良临床结果显著相关,它可以作为评估患者预后和疾病侵袭性的潜在生物标志物。高表达INHBA的患者可能需要更积极或更个性化的治疗方案。
2. 开发INHBA靶向抑制剂
直接靶向并抑制INHBA的功能,可以同时阻断其在免疫微环境重塑和铁死亡抑制上的双重致癌作用。这种“一石二鸟”的策略有望克服CRC细胞的耐药性,并增强抗肿瘤免疫反应。
3. 联合免疫铁死亡治疗策略
研究结果强烈支持将INHBA抑制剂或铁死亡诱导剂与免疫疗法结合使用。
- 铁死亡诱导剂:通过人为地诱导癌细胞发生铁死亡,可以克服INHBA对GPX4途径的保护作用。
- 免疫检查点抑制剂:
- INHBA通过促进M2极化来抑制免疫,因此,联合使用INHBA抑制剂或铁死亡诱导剂,可以逆转TME中的免疫抑制状态,使免疫检查点抑制剂(如PD-1/PD-L1抑制剂)发挥更强的疗效。
对于正在寻求更精准、更前沿治疗方案的结直肠癌患者和家属来说,了解这些基础研究的进展至关重要。虽然INHBA抑制剂尚未进入临床应用,但这一发现指明了未来药物研发的方向。患者可以关注相关的临床试验信息,或通过AI辅助问诊服务,了解最新的研究进展和个性化治疗选择。
4. 关注代谢靶点 SLC25A10
SLC25A10作为INHBA调控下的关键代谢转运蛋白,也是一个值得关注的潜在靶点。抑制SLC25A10可以切断琥珀酸盐外排的通路,同时影响线粒体氧化还原稳态,从而达到抑制肿瘤的目的。
结语:前沿研究如何转化为患者的希望?
从实验室的基础研究到临床药物的成功上市,往往需要漫长的时间。然而,正是这些分子机制的深度解析,为我们提供了战胜癌症的根本性武器。对于结直肠癌患者而言,积极了解自身肿瘤的分子特征(如INHBA的表达状态),并结合国际前沿的治疗理念,是优化治疗效果的关键。
目前,许多针对新型靶点和联合疗法的临床试验正在全球范围内进行。患者和家属可以通过专业渠道,如获取国际药物信息与治疗方案解读,了解海外最新的治疗进展,为自己争取更多的治疗机会。同时,对于国内尚未上市的创新药物,患者也可以通过合规的海外代购与国际直邮服务,安全地获取所需的抗癌药品。
INHBA在CRC中的双重致癌机制的发现,无疑为结直肠癌的精准治疗打开了一扇新的大门,预示着未来在免疫和代谢调控方面可能出现突破性的治疗方法。