一、引言:肿瘤催化-免疫联合治疗的巨大潜力
面对癌症,尤其是晚期实体瘤,单一的治疗手段往往难以实现长期、彻底的治愈。传统的化疗和放疗存在副作用大、易产生耐药性的问题;而新兴的免疫治疗虽然效果显著,但对“冷肿瘤”(免疫细胞浸润少)的响应率仍有待提高。因此,开发一种能够协同作用、优势互补的联合治疗方案,一直是癌症研究的前沿方向。
近日,哈尔滨工程大学杨飘萍团队在国际顶尖期刊《Nature Communications》上发表了一项重要研究,成功开发出一种新型的柔性亚纳米铁电催化剂(Hf0.5Zr0.5O2,简称HZO纳米线,经修饰后为THZO纳米线)。这项研究的突破性在于,它将压电催化疗法与免疫治疗巧妙地结合起来,通过超声波的非侵入性激活,不仅能高效杀伤肿瘤细胞,更能诱导肿瘤细胞发生一种特殊的死亡方式——“焦亡”(Pyroptosis),从而释放强大的免疫信号,激活患者自身的抗肿瘤免疫系统,实现了“催化+免疫”的双重抗癌效果。
对于正在寻找最新、最前沿癌症治疗方案的患者和家属而言,了解这类创新技术的研究进展,有助于拓宽治疗视野,为未来可能的临床转化做好准备。MedFind致力于提供最新的药物信息、治疗方案解读与临床研究资讯,帮助患者做出更明智的决策。
二、柔性亚纳米铁电催化剂(THZO)的创新机制
这项研究的核心在于其设计的柔性亚纳米铁电催化剂。它是一种基于氧化铪(HfO2)的纳米材料,通过引入锆(Zr)元素增强了其铁电性能和结构稳定性。
1. 压电催化疗法:超声波激活的“纳米炸弹”
压电催化疗法是一种新兴的肿瘤治疗策略。简单来说,某些材料在受到机械刺激(如超声波)时,会产生电荷分离,这种电荷分离能像催化剂一样,加速周围环境中的化学反应,最主要的就是催化水分子产生活性氧(ROS)。
活性氧(ROS)对正常细胞是必需的,但在肿瘤细胞内过量积累,则会引起严重的氧化应激,导致细胞损伤和死亡。这项研究的创新点在于:
- 柔性与亚纳米尺寸:研究团队将材料尺寸控制在亚纳米级别,使其具备类似聚合物的柔韧性,这使得纳米线在超声波作用下更容易发生铁电极化反转。
- 高效催化:这种可逆的极化反转,能够实时调控材料表面的电子态,打破了传统催化反应中吸附与脱附之间的能垒限制,从而显著提升了催化产生活性氧(ROS,如·OH、·O₂⁻)的效率,比对照的纳米颗粒结构效率更高。

2. 多酶活性协同:缓解缺氧与增强杀伤力
肿瘤组织通常处于缺氧(低氧)状态,这不仅会影响放化疗效果,也会抑制免疫细胞的活性。THZO纳米线巧妙地解决了这个问题,因为它同时具备两种“类酶”活性:
- 类过氧化氢酶(CAT)活性:能将肿瘤微环境中过量积累的过氧化氢(H₂O₂)分解为氧气(O₂)。氧气的生成有效缓解了肿瘤缺氧状态,为后续的催化和免疫治疗创造了更有利的条件。
- 类过氧化物酶(POD)活性:能将H₂O₂分解生成具有强杀伤作用的羟基自由基(·OH),这是一种活性氧,即使在没有超声刺激的“静默”状态下,也能对肿瘤细胞进行催化杀伤。
这种“一石二鸟”的设计,确保了催化剂在肿瘤微环境中能够持续工作,既能改善环境,又能增强杀伤力。
三、核心突破:通过“焦亡”实现免疫激活
该研究最引人注目的突破点在于,THZO纳米线与超声波(THZO + US)联合作用,能够诱导肿瘤细胞发生焦亡(Pyroptosis),而不是更常见的凋亡(Apoptosis)。
1. 焦亡:比凋亡更强大的免疫信号
细胞死亡主要有两种形式:
- 凋亡(Apoptosis):细胞安静、有序地死亡,细胞膜保持完整,内容物不会释放,因此不会引起炎症,免疫系统通常不会被激活。
- 焦亡(Pyroptosis):是一种高度炎症性的程序性细胞死亡。它由Caspase-1/GSDMD通路激活,导致细胞膜形成孔洞,细胞内容物(包括炎症因子和损伤相关分子模式,DAMPs)大量释放,如同“爆炸”一般。
这些释放出的DAMPs(如ATP、核酸等)就像免疫系统的“危险信号”,能够强力招募和激活免疫细胞。
研究结果通过Western blot分析证实,THZO + US处理肿瘤细胞后,成功激活了Caspase-1,并切割了GSDMD蛋白,从而触发了焦亡通路。这种焦亡的发生,是实现高效免疫激活的关键。
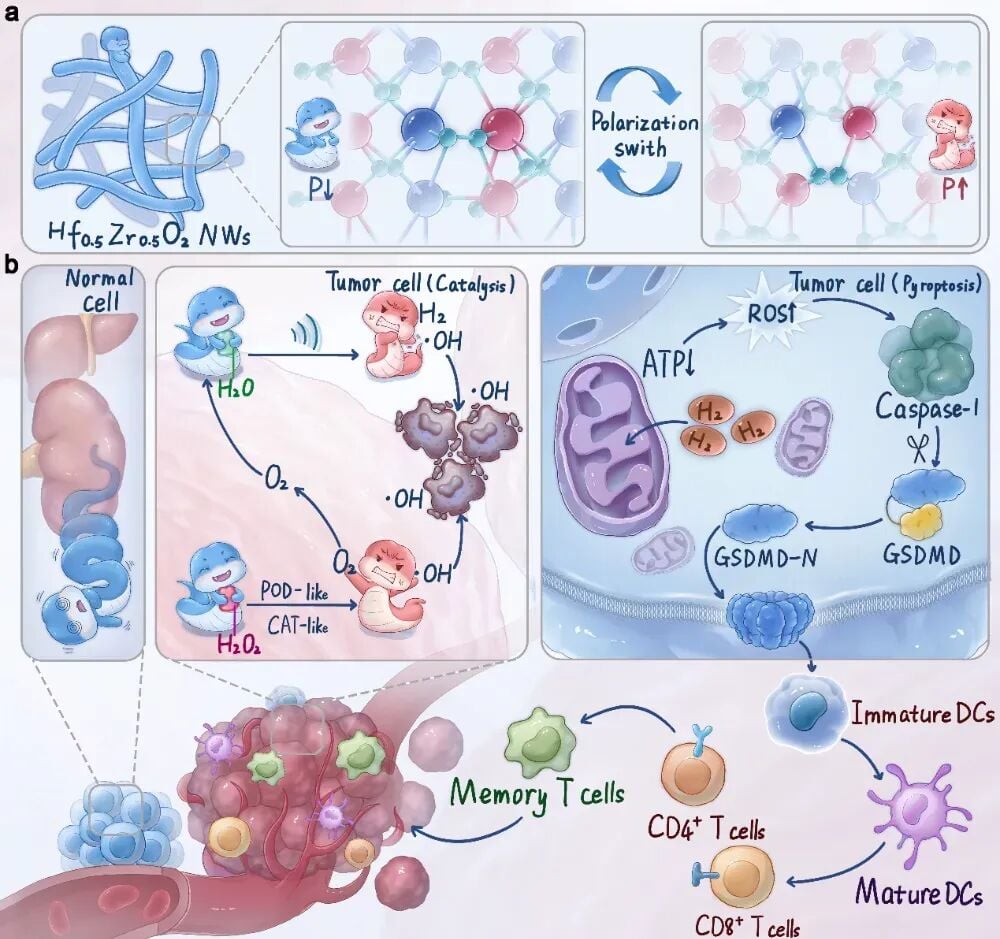
图1 高效氧化锌纳米线的结构示意图及协同治疗机制
2. 体内实验验证:强大的抑瘤效果与免疫浸润
在荷瘤小鼠模型(4T1乳腺癌模型)中,THZO + US联合治疗展现出强大的肿瘤抑制效果,肿瘤组织发生了广泛的焦亡。
更重要的是免疫分析结果:
- 树突状细胞(DC)成熟:焦亡释放的DAMPs促进了树突状细胞的大幅成熟。DC是免疫系统的“指挥官”,负责捕获肿瘤抗原并将其呈递给T细胞。
- T细胞浸润:成熟的DC随后激活了T细胞,导致肿瘤组织内CD8⁺(杀伤性T细胞)和CD4⁺ T细胞的浸润显著增加。这些T细胞是免疫系统清除肿瘤的“主力军”。
这表明,这种联合治疗不仅在局部通过催化作用杀死了肿瘤细胞,更通过诱导焦亡,成功地将肿瘤从“冷肿瘤”转化为“热肿瘤”,激活了机体自身的全身性抗肿瘤免疫反应,从而实现了长效的免疫监视,有效防止肿瘤复发和转移。
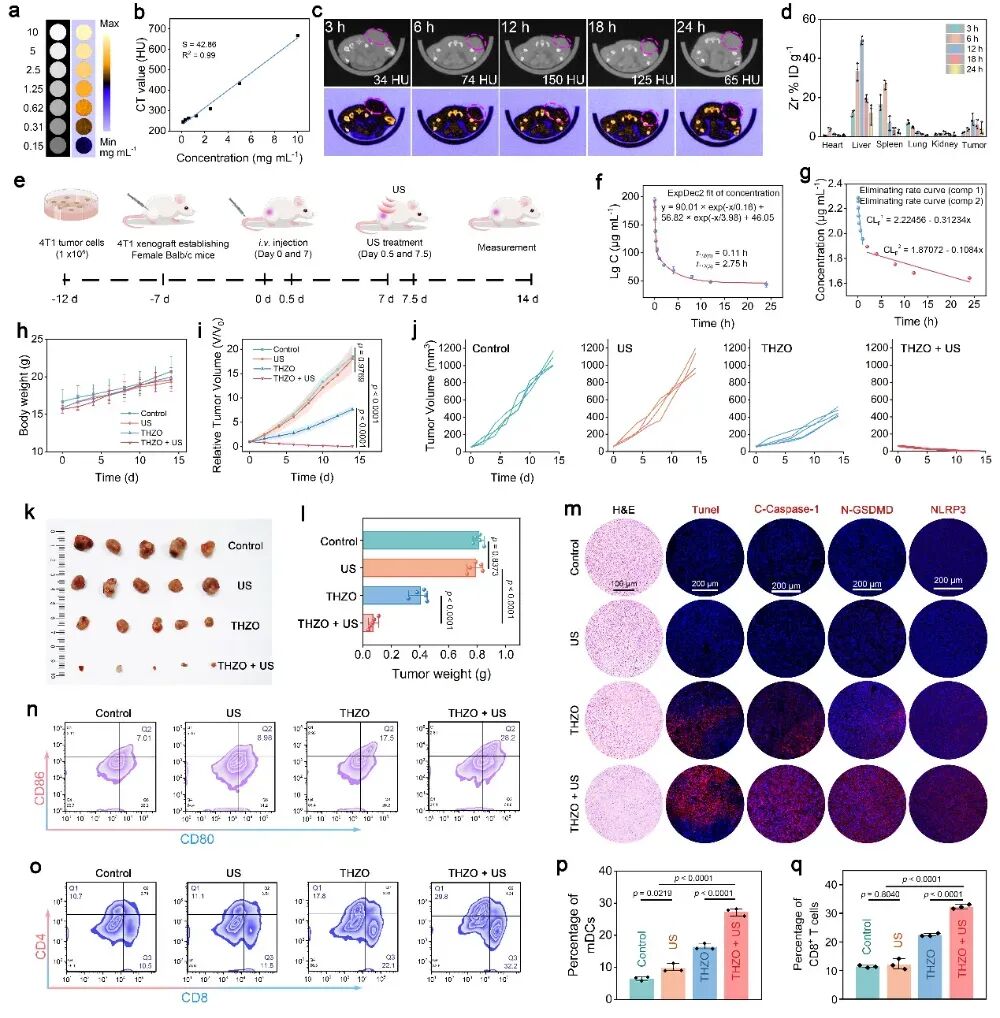
图6 CT成像及THZO纳米线在对抗4T1肿瘤模型中的体内疗效研究
四、总结与展望:癌症治疗的新方向
这项研究成功地将材料科学、物理学和肿瘤治疗学相结合,开发出一种高效、柔性的亚纳米铁电催化剂。它通过以下三重机制,为癌症治疗提供了新的思路:
- 物理催化:利用超声波诱导的极化反转,高效产生活性氧(ROS),直接杀伤肿瘤细胞。
- 生化协同:利用多酶活性(CAT/POD),分解肿瘤微环境中的H₂O₂,既缓解缺氧又增强杀伤。
- 免疫激活:通过诱导肿瘤细胞焦亡,释放免疫信号,激活全身抗肿瘤免疫系统,实现长效抗癌。
这种“催化-免疫”一体化的治疗策略,有望克服传统治疗的局限性,为实体瘤患者带来更高效、更精准、副作用更小的治疗选择。虽然目前仍处于临床前研究阶段,但其原理和效果已经为未来癌症纳米医学的发展奠定了坚实的材料基础。
对于癌症患者而言,了解这类前沿研究的进展至关重要。如果您对最新的癌症治疗方案、药物选择或临床试验有任何疑问,可以通过AI 辅助问诊服务获取专业的初步咨询与信息解读。同时,MedFind也提供全球抗癌药物的代购与国际直邮服务,帮助患者及时获取所需的创新药物。
附:研究细节图文解析
材料结构与铁电性能表征
研究团队采用热裂解法成功获得了HZO纳米线,并验证了亚纳米尺度赋予HZO纳米线的类聚合物柔韧性。压电力显微镜(PFM)测试观测到,经TPP修饰的HZO(THZO)纳米线在电场下仍表现出清晰的压电响应与180°的极化相位翻转,证实了其可逆的铁电极化能力。
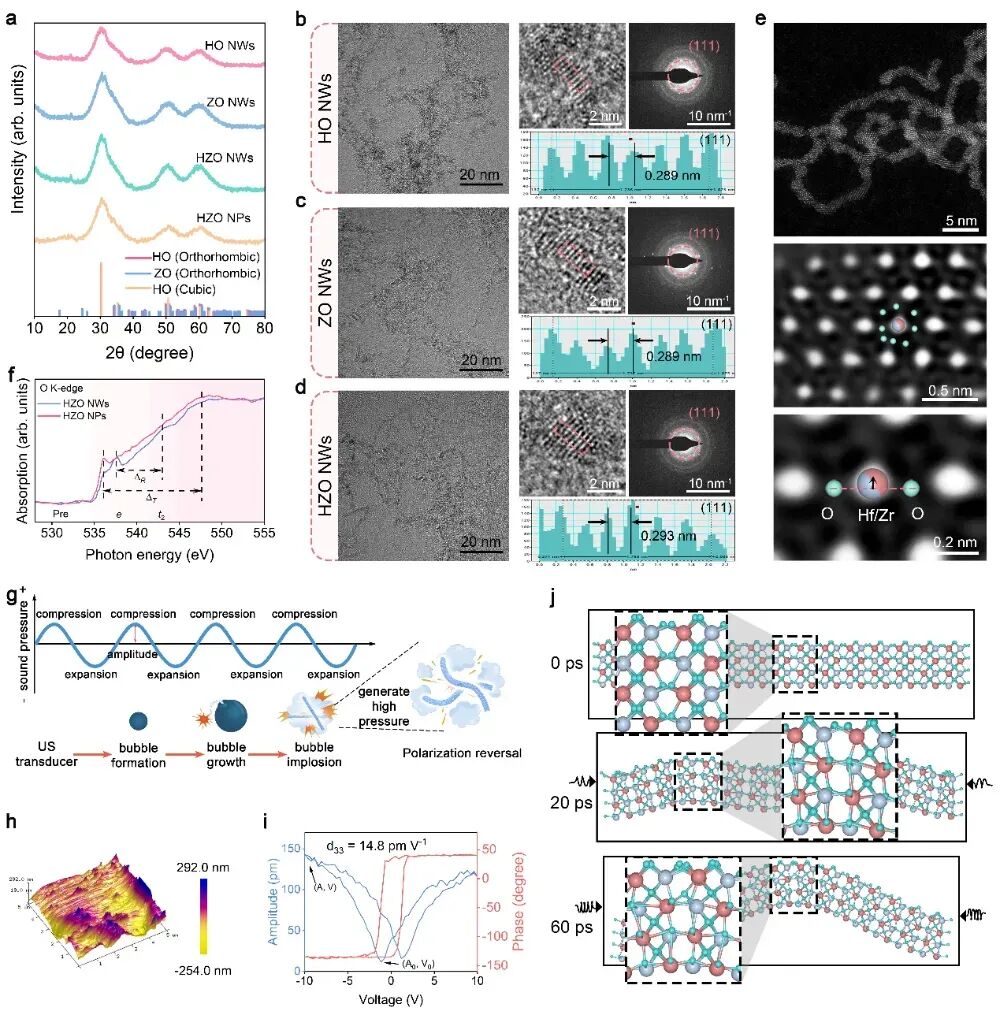
图2 HZO 纳米线的特性及铁电极化
能带结构与催化机理
理论计算与实验证实,在超声波作用下,THZO纳米线内部形成内置压电场,导致能带弯曲,促进了电子-空穴的分离。密度泛函理论(DFT)计算揭示了其中的精妙调控:向下极化的表面更利于氢原子(H*)吸附,而向上极化的表面则利于氢气分子(H₂)脱附。这种通过超声实时切换的极化状态,打破了吸附与脱附之间的标度关系,促进了高效产氢。
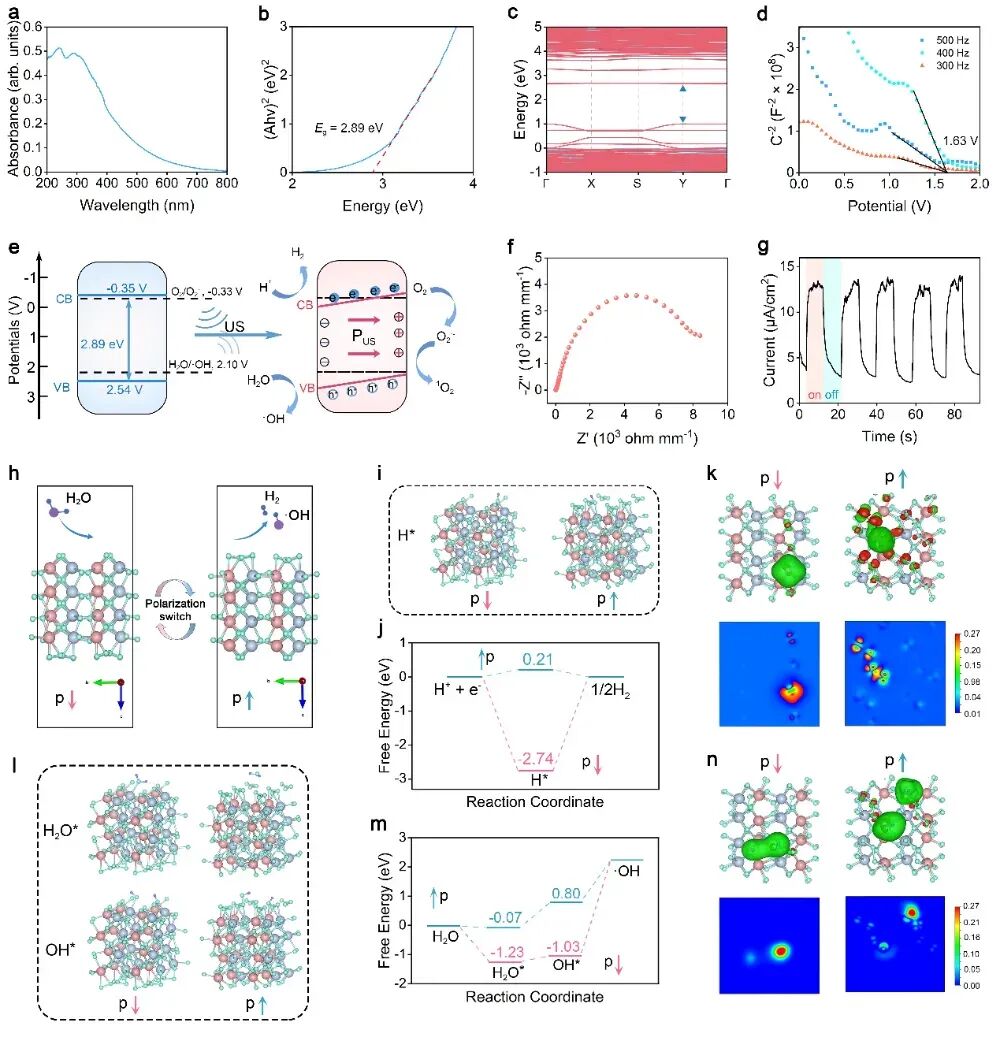
图3 通过密度泛函理论(DFT)计算,提出了不同方向极化的THZO纳米线的物理性质以及其水解过程
ROS生成与酶活性验证
实验证明,THZO纳米线在超声作用下可高效产生·OH、·O₂⁻等多种活性氧,其效率远高于纳米颗粒结构的THZO对照样。此外,材料本身还展现出优异的类过氧化氢酶(CAT)和类过氧化物酶(POD)活性,确保了在肿瘤微环境中的持续催化能力。
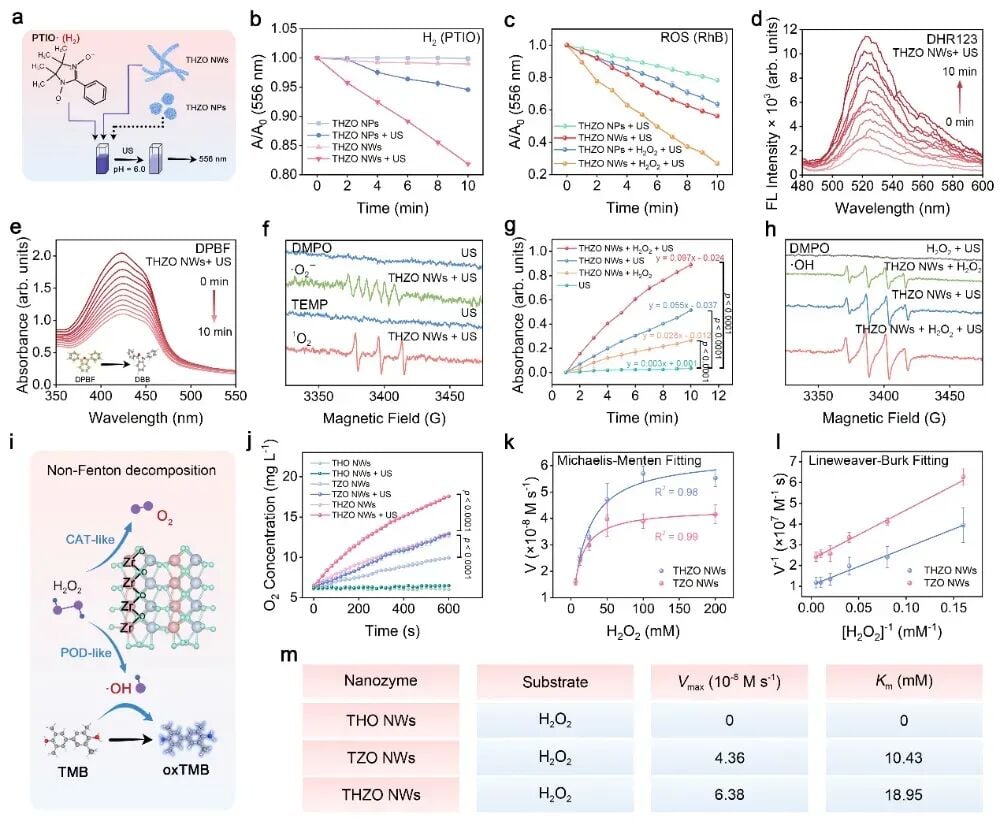
图4 THZO纳米线的ROS生成特性
细胞摄取与体外抗肿瘤效果
通过TPP靶向修饰,THZO纳米线可精准定位至细胞线粒体。在超声协同下,材料产生的大量ROS导致线粒体氧化应激,最终驱动细胞凋亡与焦亡。划痕实验与克隆实验均表明,“THZO + US”组合能更有效抑制肿瘤细胞的迁移与增殖能力,并激活Caspase-1/GSDMD通路,触发焦亡。
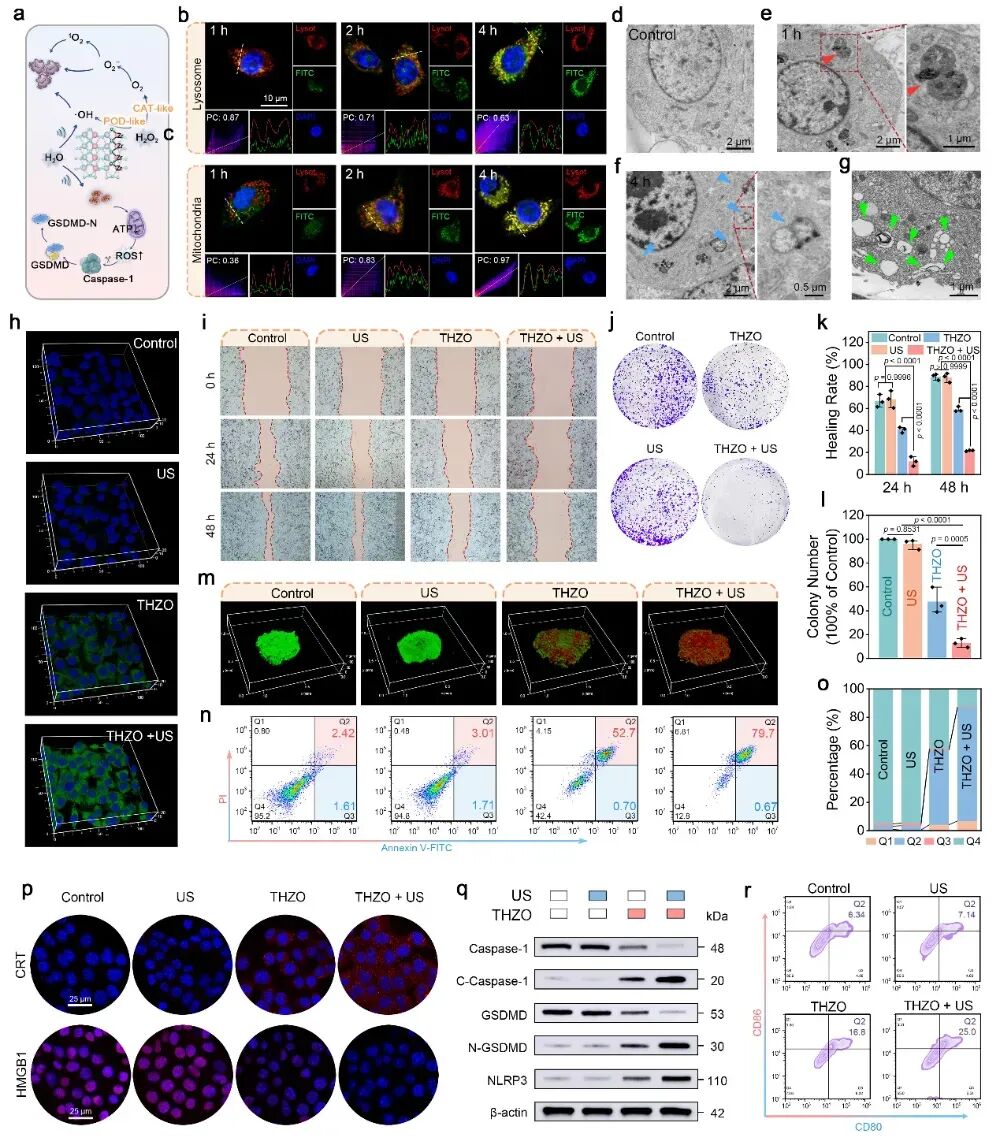
图5 体外细胞摄取及细胞焦亡





