癌症,作为全球性的健康挑战,其治疗策略正不断演进。近年来,免疫疗法,特别是免疫检查点抑制剂(如抗PD-1药物),为众多癌症患者带来了新的希望。然而,仍有相当一部分患者对现有免疫疗法响应不佳或产生耐药性。因此,探索新的增敏策略,以提升免疫治疗效果,成为当前癌症研究的热点。
在众多潜在的辅助治疗手段中,饮食干预,尤其是饮食限制(Dietary Restriction, DR),长期以来被认为具有延缓肿瘤生长的潜力。然而,其背后的具体机制,特别是免疫系统在其中扮演的角色,此前并未被完全阐明。近期,范安德尔研究所Russell G. Jones教授团队在国际顶尖期刊《Nature Metabolism》上发表了一项突破性研究,系统揭示了饮食限制如何通过重编程CD8+ T细胞的命运与代谢,从而增强抗肿瘤免疫力并协同提升免疫治疗效果。
研究背景:饮食与肿瘤免疫的交织
CD8+ T细胞是机体抗肿瘤免疫反应的核心力量,它们能够识别并清除癌细胞。然而,在肿瘤微环境(Tumor Microenvironment, TME)中,由于慢性抗原刺激、营养匮乏和炎症压力,CD8+ T细胞常常陷入代谢紊乱和功能耗竭状态,这导致了肿瘤的免疫逃逸和对免疫治疗的耐药性。T细胞耗竭表现为T细胞功能受损、增殖能力下降以及持续表达抑制性受体(如PD-1)。近年来,越来越多的研究表明,T细胞的命运决定与其代谢状态紧密相关。例如,酮体等营养物质被发现能够增强线粒体氧化代谢和乙酰辅酶A的生成,进而维持T细胞的效应功能。
饮食作为影响机体整体代谢的关键因素,自然也能够重塑肿瘤微环境的营养组成。因此,研究人员推测,饮食限制可能通过调节T细胞的代谢状态,来影响其抗肿瘤功能。这项研究正是基于这一假设,深入探索了饮食限制在癌症治疗中的免疫代谢机制,为我们理解如何通过营养干预来优化癌症治疗提供了新的视角。
核心发现一:饮食限制重塑CD8+ T细胞命运,增强抗肿瘤免疫
研究团队首先在C57BL/6小鼠模型中验证了饮食限制(DR)的抗肿瘤效果。DR通常指在不引起营养不良的前提下,减少总能量摄入。结果显示,DR能够显著降低小鼠的体重和脂肪量,并有效延缓B16-OVA黑色素瘤和EO771乳腺癌的生长曲线,显著延长了小鼠的无瘤生存期。这初步证实了DR在多种肿瘤模型中的治疗潜力。
为了探究免疫系统在DR抗肿瘤效应中的作用,研究人员进行了免疫组化和流式细胞术分析。他们发现,DR处理的肿瘤内部CD8+ T细胞浸润显著增加,并且PD1lo效应亚群(即PD-1表达较低,具有更强杀伤能力的T细胞)也明显扩张。更关键的是,在Rag2-/-小鼠(这类小鼠由于基因缺陷,无法产生成熟的T细胞和B细胞,因此免疫系统功能严重受损)或通过CD8抗体清除CD8+ T细胞的实验中,DR的抗肿瘤优势完全消失。同样,在裸鼠实验中(裸鼠因胸腺发育不全而缺乏T细胞),DR也未能抑制肿瘤生长。这些结果有力地证明,CD8+ T细胞是介导DR抗肿瘤效应的关键因素,而非仅仅通过直接影响癌细胞本身。

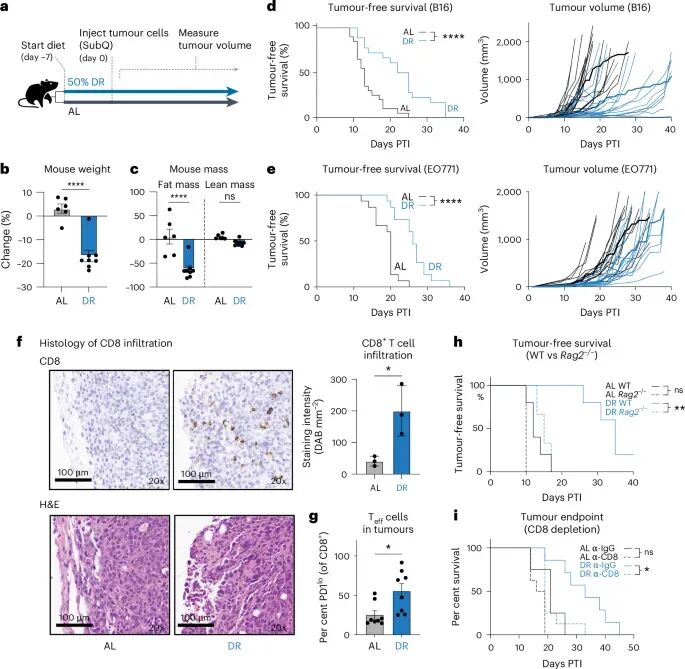
图1 T细胞介导DR的抗肿瘤效应
核心发现二:DR提升T细胞代谢适应性与抗耗竭能力
进一步的分析显示,DR不仅增加了CD8+ T细胞的数量,还显著提高了其效应功能。例如,DR条件下T细胞的颗粒酶B(GzmB)表达上调,这是一种重要的细胞毒性分子,能够直接杀伤靶细胞。同时,干细胞样标志物LY108也增强,提示T细胞具有更好的自我更新和扩增能力,这对于长期维持抗肿瘤免疫反应至关重要。
结合OT-I过继转移和LmOVA感染模型,蛋白质组学分析揭示,DR条件下效应T细胞上调了三羧酸循环(TCA循环)、E2F和MYC等与代谢和增殖相关的通路。TCA循环是细胞产生能量的核心代谢途径。通过13C标记和Seahorse检测(一种测量细胞呼吸和糖酵解的实验技术),研究人员证实DR显著提升了T细胞的基础和最大氧化磷酸化水平(细胞通过线粒体产生ATP的主要方式)、糖酵解ATP产量以及线粒体膜电位。这些数据表明,DR能够全面增强CD8+ T细胞的代谢适应性,使其在肿瘤微环境中保持更强的能量产生能力,从而更好地执行其杀伤功能。
更重要的是,DR还能够有效拮抗肿瘤微环境中CD8+ T细胞的终末耗竭。研究发现,DR显著扩张了Tox-lo(低表达Tox,Tox是T细胞耗竭的关键转录因子)内的增殖性效应T细胞(Teff)以及Tox-hi(高表达Tox)中具有GzmB/IFN-γ/TNF效应分子的效应耗竭T细胞(Tex-eff)亚群。与此同时,中间耗竭T细胞(Tex-int)和终末耗竭T细胞(Tex-term)的比例则明显下降。RNA速率推断显示,T细胞的分化方向从常规饮食(AL)下的“效应→Tex-int→Tex-term”转变为DR下的“效应→Tex-eff”。流式细胞术验证了DR处理的肿瘤内部TOX+PD1+终末耗竭细胞减少,且残留的TOX+细胞表达更低的PD1和更高的LY108、TCF1,并能产生更多的干扰素-γ(IFN-γ)。这表明DR能够有效逆转T细胞的耗竭进程,使其保持或恢复效应功能,从而增强抗肿瘤免疫力。
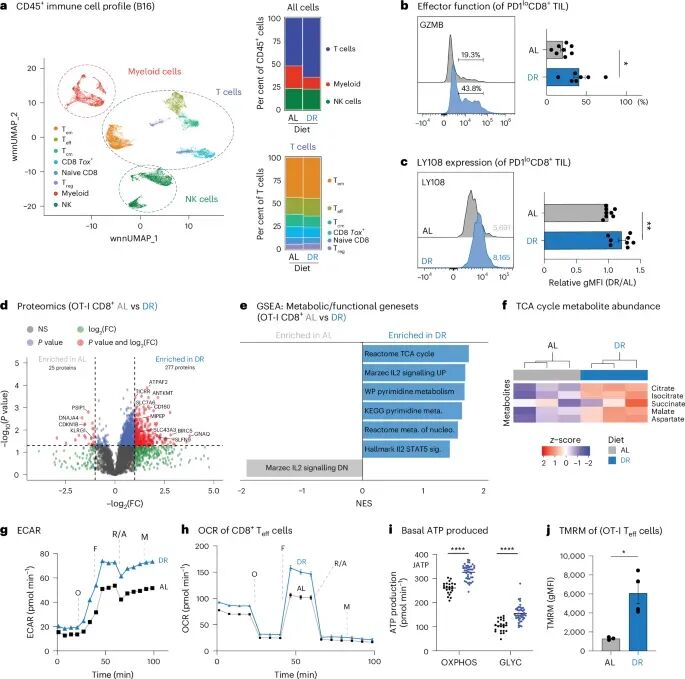
图2 DR增强CD8+ T细胞效应反应和体内代谢适应性
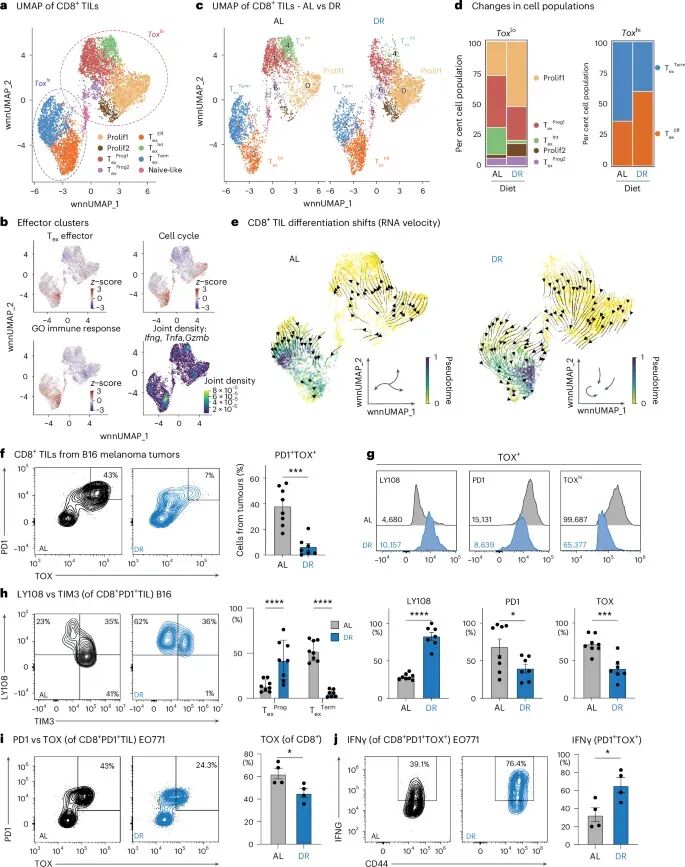
图3 DR拮抗TME末端CD8+ T细胞耗尽
核心发现三:酮体——DR抗肿瘤效应的关键介质
为了揭示DR诱导T细胞代谢重编程的具体分子机制,研究人员将目光投向了酮体。DR通常会导致机体呼吸交换比降低,动员脂肪,从而使肿瘤内脂质减少,而血清和肿瘤内的β-羟丁酸(βOHB)水平显著升高。βOHB是一种主要的酮体,在禁食或低碳水化合物饮食状态下由肝脏产生,作为葡萄糖的替代能源,为大脑和肌肉等组织提供能量。在肿瘤微环境中,癌细胞通常优先利用葡萄糖,导致其他营养物质相对富集,这可能为T细胞利用酮体创造了条件。
体外实验中,直接给予βOHB或体内DR处理均能增强OT-I细胞的最大氧耗和氧化ATP产量。通过13C-葡萄糖和13C-βOHB双标记实验(一种追踪特定分子在代谢途径中去向的技术),研究发现DR处理的T细胞对βOHB来源的M+1柠檬酸和乙酰辅酶A的利用翻倍,而malate/citrate比值的下降进一步提示,更多的柠檬酸通过βOHB的代谢途径在外源性生成胞质乙酰辅酶A。这表明βOHB能够作为T细胞的重要燃料,直接参与其能量代谢,并促进关键代谢中间产物的生成,从而为T细胞的增殖和效应功能提供充足的能量和生物合成前体。
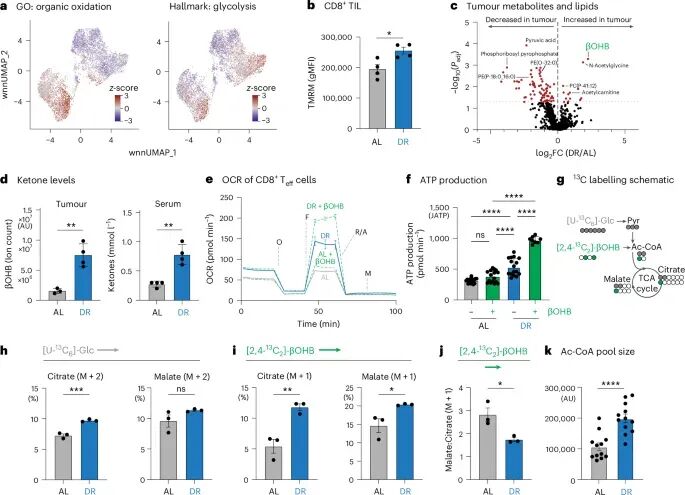
图4 DR通过酮体代谢增强CD8+ T细胞的代谢适应性
酮体代谢与T细胞功能:深入机制解析
为了进一步探究酮体代谢在T细胞功能中的作用,研究人员在体外建立了慢性TCR刺激诱导T细胞耗竭的模型。他们发现,持续的TCR信号能够促进CD8+ T细胞摄取并氧化13C-βOHB,生成柠檬酸并维持乙酰辅酶A的水平,而葡萄糖和乙酸的贡献则相应下降。这提示在慢性刺激下,T细胞可能更倾向于利用酮体作为能量来源,以应对葡萄糖供应不足或代谢压力。
对应分析人类肿瘤的单细胞数据,研究人员发现与小鼠Tex-eff(效应耗竭T细胞)对应的增殖性耗竭亚群高表达酮解关键酶BDH1和OXCT1。BDH1(β-羟丁酸脱氢酶1)和OXCT1(3-酮酰辅酶A转移酶1)是酮体在细胞内转化为乙酰辅酶A的关键酶。其中,BDH1在效应T细胞和耗竭前体细胞中均有升高。这些发现进一步支持了酮体代谢在维持T细胞功能,尤其是在对抗耗竭方面的重要性,并提示这一机制可能在人类癌症中也存在,为未来临床转化提供了潜在的靶点。
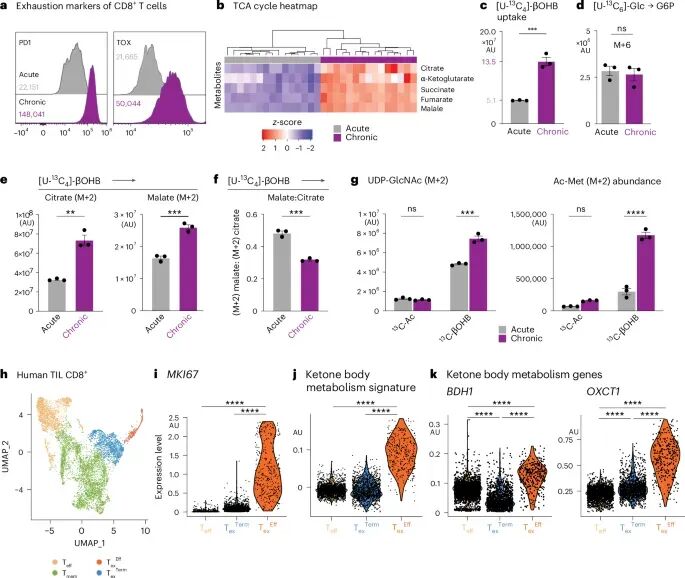
图5 慢性TCR刺激促进βOHB代谢增加
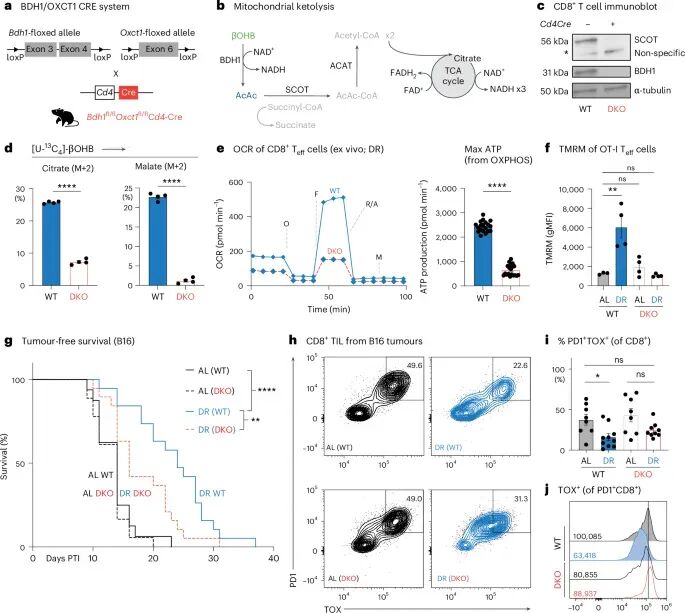
图6 T细胞对酮的氧化促进了DR的抗肿瘤效果
T细胞酮体氧化:DR抗肿瘤效果的决定性因素
为了最终确认T细胞酮体氧化的关键作用,研究团队构建了T细胞特异性双敲除Bdh1和Oxct1(DKO)的小鼠模型。这意味着这些小鼠的T细胞无法有效利用酮体作为能量来源。结果显示,在DKO小鼠中,DR诱导的βOHB氧化被阻断后,抗原特异性CD8+ T细胞无法提升氧耗、最大氧化ATP产量以及线粒体膜电位,尽管小鼠的体重和脂肪变化与野生型小鼠一致。这直接证明了T细胞酮体代谢对DR效应的重要性,排除了DR通过其他非T细胞途径影响肿瘤生长的可能性。
在B16-OVA肿瘤实验中,DKO小鼠在DR条件下肿瘤生长显著加速,瘤内PD1+TOX+终末耗竭T细胞比例升高,且TOX平均荧光强度无法下调。这表明,如果T细胞无法有效利用酮体,即使进行饮食限制,也无法发挥其抗肿瘤作用,反而会导致T细胞耗竭的加剧和肿瘤的快速进展。这一系列实验严谨地证实了T细胞酮体氧化是DR发挥抗肿瘤效果的决定性机制,为我们理解饮食与免疫的复杂互作提供了坚实的证据。
DR与抗PD-1免疫疗法协同增效
这项研究最令人振奋的发现之一是DR与免疫检查点抑制剂(如抗PD-1治疗)的协同作用。抗PD-1药物通过阻断PD-1与PD-L1的结合,解除T细胞的“刹车”,使其重新激活并攻击癌细胞。在B16-OVA模型中,当肿瘤可触及时启动抗PD-1治疗,研究人员发现DR能够显著放大PD-1阻断的疗效,使得约15%的小鼠实现了长期无瘤生存。联合治疗组的肿瘤内部PD1loTOXlo效应T细胞比例升高了三倍,Tex-term群体减少,且残留的TOX+细胞TOX水平更低,GZMB与IFN-γ/TNF双阳性比例显著增加。这表明DR能够有效改善肿瘤微环境中的免疫抑制状态,使T细胞更好地响应抗PD-1治疗,从而实现更持久的抗肿瘤效果。
然而,在DKO小鼠中,DR与抗PD-1联合治疗的生存获益完全消失,肿瘤生长和耗竭T细胞积累与对照组无异。这再次强调了T细胞酮体代谢在DR协同免疫治疗中的核心地位。这一发现为临床上通过饮食干预来提升免疫检查点抑制剂的疗效提供了强有力的理论依据,有望为难治性癌症患者带来新的治疗突破。
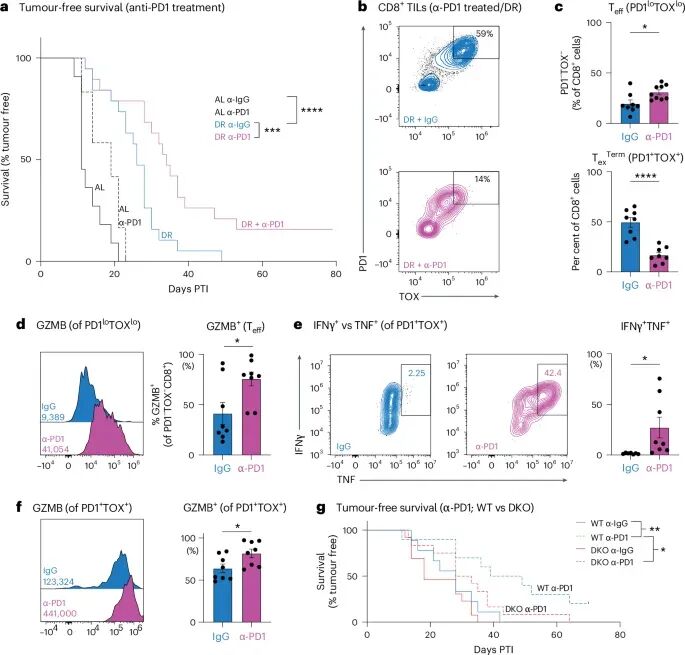
图7 DR与抗PD1免疫疗法协同增强抗肿瘤免疫
了解更多癌症治疗方案和药物信息,请访问 MedFind 药物信息平台。
临床意义与未来展望
这项发表在《Nature Metabolism》上的研究,通过小鼠肿瘤模型结合单细胞多组学、代谢示踪和基因敲除等先进手段,系统阐明了饮食限制(DR)通过升高全身及肿瘤内β-羟丁酸(βOHB)水平,直接重塑CD8+ T细胞的代谢与命运。酮体氧化增强了TCA循环和氧化磷酸化,扩大了瘤内效应亚群并抑制了终末耗竭,从而显著延缓了肿瘤生长。这种代谢重编程不仅是DR增强抗肿瘤免疫的核心机制,也是其与抗PD-1治疗产生协同效应的关键。
这项研究为利用营养干预提升癌症免疫疗效提供了重要的理论依据和潜在策略。未来,针对癌症患者,特别是对免疫检查点抑制剂响应不佳或产生耐药的患者,可以考虑探索基于酮体代谢的营养干预方案,例如严格的生酮饮食或βOHB补充剂。生酮饮食是一种高脂肪、适量蛋白质、低碳水化合物的饮食模式,旨在模拟饥饿状态,促使身体产生酮体。然而,将这些研究成果转化为临床实践仍需谨慎,需要更多人体临床试验来验证其安全性、有效性和最佳实施方案,并评估其在不同癌症类型和患者群体中的适用性。
对于海外创新药物的获取,例如文中提及的免疫检查点抑制剂等,患者及家属可通过 MedFind 国际直邮服务 了解详情。
此外,个性化营养干预方案的制定,需要充分考虑患者的肿瘤类型、疾病阶段、身体状况以及其他治疗方案。在考虑任何治疗方案前,建议咨询专业医生。您也可以通过 MedFind AI 辅助问诊服务 获取初步的专业建议,以便更好地了解潜在的治疗选择和风险。
总而言之,这项研究不仅加深了我们对肿瘤免疫代谢的理解,也为开发新的癌症治疗策略,特别是结合饮食干预和免疫疗法的综合方案,指明了方向。随着更多深入研究的开展,我们期待这些前沿科学发现能早日惠及广大癌症患者,为他们带来更有效、更持久的抗癌希望。