中枢神经系统肿瘤:亟待突破的医学难题
中枢神经系统(CNS)恶性肿瘤,尤其是胶质母细胞瘤(Glioblastoma),是医学界面临的最严峻挑战之一。这类肿瘤预后极差,原发性脑瘤患者的年死亡率高达诊断数量的76%。以胶质母细胞瘤为例,即使采用手术、放疗和化疗的标准化治疗方案,患者的中位总生存期(OS)也仅有短短的12至15个月,这一数据在过去几十年间未见显著改善。因此,开发创新且有效的治疗策略已成为当务之急。
近年来,CAR-T细胞疗法在血液肿瘤领域取得了革命性的成功,为无数患者带来了治愈的希望。然而,当这种强大的“活体药物”被应用于治疗中枢神经系统内的实体瘤时,却遭遇了前所未有的障碍。尽管挑战重重,但最新的临床研究,特别是针对胶质瘤、弥漫性中线胶质瘤(DMG/DIPG)和CNS淋巴瘤的试验,已经展现出令人鼓舞的生物活性信号,甚至出现了持久缓解的案例。这些突破促使科学家们重新审视并优化CAR-T疗法的设计,以期攻克这片癌症治疗的“最后堡垒”。一篇发表于《自然综述·临床肿瘤学》(Nature Reviews Clinical Oncology)的重磅综述,系统性地评估了CAR-T治疗CNS肿瘤的临床现状与未来方向。想要了解更多前沿抗癌资讯,可以访问MedFind资讯。
跨越天堑:CAR-T疗法在脑瘤治疗中的独特挑战
将CAR-T疗法成功应用于脑瘤治疗,必须克服一系列独特的生理和病理障碍:
- 血脑屏障(Blood-Brain Barrier, BBB):这是大脑的天然防御系统,能有效阻止有害物质进入,但同时也阻碍了CAR-T细胞从血液循环进入脑部肿瘤部位,大大削弱了其杀伤效力。
- 高度免疫抑制的肿瘤微环境(TME):脑肿瘤内部及其周围环境充满了抑制免疫反应的细胞和分子,如同为肿瘤建立了一个“保护罩”,使进入的CAR-T细胞功能受损,难以发挥作用。
- 肿瘤抗原异质性:同一个肿瘤内的癌细胞并非完全相同,它们表达的靶点抗原可能存在差异或缺失。这导致靶向单一抗原的CAR-T细胞无法清除所有癌细胞,容易引发肿瘤复发。
- 独特的神经毒性风险:由于治疗作用于大脑这一精密器官,CAR-T疗法可能引发独特的神经系统毒副作用,如免疫效应细胞相关神经毒性综合征(ICANS),这对治疗的安全性提出了更高要求。

曙光初现:CAR-T在不同CNS肿瘤临床试验中的表现
尽管面临诸多挑战,科学家们通过创新的策略,已在多种CNS肿瘤的临床试验中取得了重要进展。美国宾夕法尼亚大学的Donald M. O’Rourke教授团队的综述对此进行了详细总结。
成人胶质瘤:从单靶点到多策略的演进
在成人胶质瘤的早期试验中,针对单一靶点(如IL-13Rα2或EGFR)的CAR-T疗法虽然展示了一定的安全性,但疗效有限,且容易出现因抗原丢失导致的耐药。为了克服这一问题,研究人员开发了更先进的策略:
- 双价CAR-T:例如同时靶向EGFR和IL-13Rα2的双价CAR-T细胞,能够识别和攻击更多种类的肿瘤细胞,提高了治疗的广度。
- 分泌TEAM抗体的CAR-T:CARV3-TEAM-E是一种更智能的设计,它不仅能直接杀伤肿瘤细胞,还能分泌一种叫做“T细胞接合抗体分子(TEAM)”的物质,招募患者体内自身的T细胞一同攻击肿瘤,放大了抗癌效果。
这些新策略通过脑室内给药,显著提升了肿瘤的消退率。虽然伴随发生了可控的神经毒性,但其展现出的强大疗效预示着胶质瘤治疗的新方向。
成人CNS淋巴瘤:系统性给药的巨大成功
与实体瘤不同,CNS淋巴瘤的治疗取得了显著成功。通过传统的静脉输注方式,靶向CD19的CAR-T疗法(如axicabtagene ciloleucel)在CNS淋巴瘤患者中表现出极高的疗效,总缓解率(ORR)高达94%,其毒性特征与治疗其他系统性B细胞淋巴瘤时相似,证明了其在该领域的巨大潜力。
儿童DMG/DIPG:局部递送带来的生存突破
对于恶性程度极高的儿童弥漫性中线胶质瘤(DMG/DIPG),CAR-T疗法同样带来了希望。通过脑室内重复输注靶向GD2和B7-H3的CAR-T细胞,患者的中位总生存期被显著延长至17.6-19.8个月,而历史数据显示这一数字仅为11.2个月。更重要的是,研究证实,这种局部给药方式能够有效逆转静脉给药时遇到的免疫抑制微环境,为CAR-T细胞创造更有利的战斗条件。
精准制导:给药途径是决定疗效的关键
如何将CAR-T细胞高效、安全地送达肿瘤部位,是治疗CNS肿瘤成败的关键。目前的给药途径主要有三种:
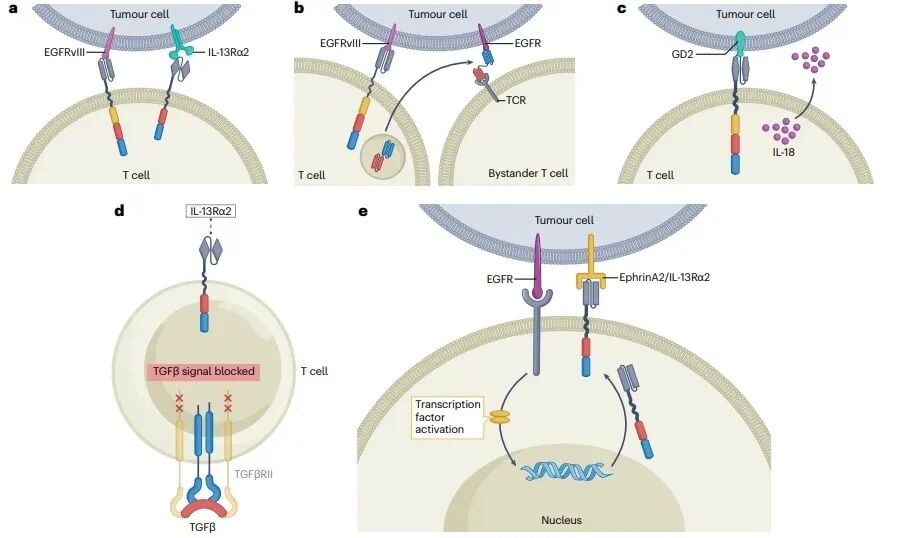
图3:中枢神经系统恶性肿瘤患者中CAR T 细胞的给药途径
- 静脉(i.v.)给药:操作最便捷,但大量CAR-T细胞被血脑屏障阻挡,且可能引发严重的全身性毒副作用。
- 瘤内/腔内给药:直接将细胞注射到肿瘤或切除后的瘤腔内,局部药物浓度最高,但分布范围有限,可能无法覆盖所有浸润的肿瘤细胞。
- 脑室内(ICV)给药:通过手术植入的Ommaya储液囊,将CAR-T细胞直接输注到脑脊液中。这种方式可以使CAR-T细胞在整个中枢神经系统内循环,广泛接触肿瘤细胞,并且可以方便地进行重复给药和采样监测。
大量证据表明,对于CNS实体瘤,精准的局部递送(尤其是脑室内给药)在药代动力学和安全性方面均显著优于全身性给药,是目前最优选的策略。
未来展望:下一代“智能”CAR-T的设计蓝图
为了进一步提升疗效并降低风险,科学家们正在开发一系列更“智能”的下一代CAR-T技术:
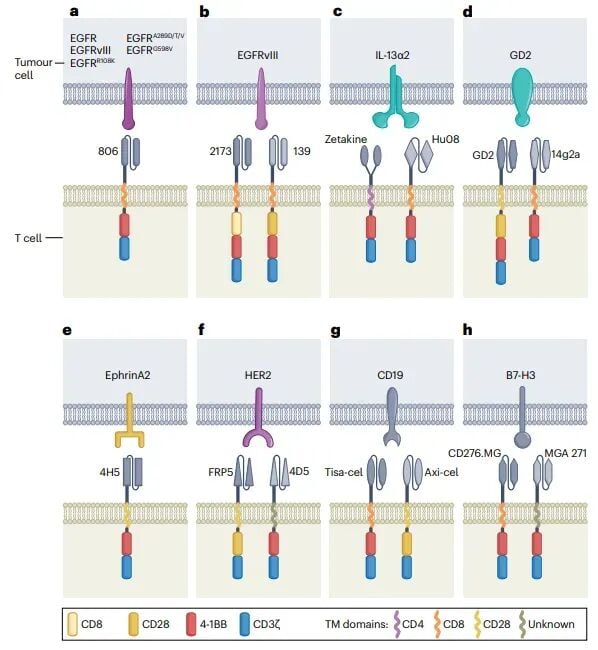
图1:当前及未来的CAR设计与目标
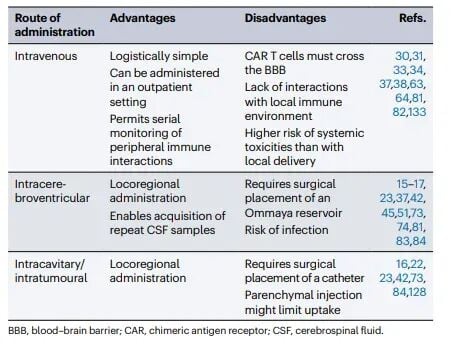
图2:未来CNS肿瘤CAR-T治疗策略
- 逻辑门控系统(synNotch):如同给CAR-T细胞安装一个“双重保险”,只有当它同时识别到两种不同的肿瘤抗原时,才会激活杀伤功能,极大地提高了靶向的精准度和安全性。
- “装甲型”CAR-T:通过基因工程改造,让CAR-T细胞能够分泌IL-18等增强免疫的细胞因子,或表达显性负性TGFβ受体来抵抗肿瘤微环境的抑制信号,使其战斗力更持久。
- CNS特异性靶向:开发针对脑部特有分子(如brevican)的CAR-T,使其能更好地在CNS中停留和富集。
- 异体“现货型”CAR-T:使用健康捐赠者的T细胞制备CAR-T,可以提前生产、储存,患者无需等待即可使用,解决了自体CAR-T制备周期长、成本高昂的问题。
总结
CAR-T细胞疗法为攻克中枢神经系统恶性肿瘤这一医学堡垒带来了前所未有的希望。尽管挑战依然存在,但通过精准的局部递送、多靶点识别的智能设计以及重塑肿瘤微环境的创新策略,我们正逐步绘制出CAR-T最终战胜CNS肿瘤的宏伟蓝图。这些前沿的临床研究进展,无疑为身处困境的脑瘤患者及其家庭点亮了一盏明灯。
虽然这些尖端疗法多数仍在临床试验阶段,但了解最新的治疗动态对于制定最佳治疗策略至关重要。对于需要获取已获批的靶向或免疫治疗药物的患者,MedFind致力于提供专业、可靠的海外药品直邮服务,确保您能第一时间获得救命良药。如果您对自己的病情或治疗方案有任何疑问,欢迎使用我们的AI问诊服务,获取个性化的深度解读和建议。