攻克癌症治疗的“硬骨头”:肿瘤缺氧微环境
在与癌症的漫长斗争中,科学家们面临着一个共同的难题——肿瘤微环境(Tumor Microenvironment, TME)。肿瘤并非一堆孤立的癌细胞,而是一个复杂的“生态系统”,其中包含了血管、免疫细胞、成纤维细胞等多种成分。这个微环境的一个显著特征就是“缺氧”(Hypoxia)。由于肿瘤细胞生长迅速,内部血管发育畸形,导致氧气供应不足,形成了一个低氧区域。这个缺氧环境不仅会保护癌细胞免受放疗和化疗的攻击,还会抑制免疫系统的监视功能,成为癌症治疗中一块极难啃的“硬骨头”。
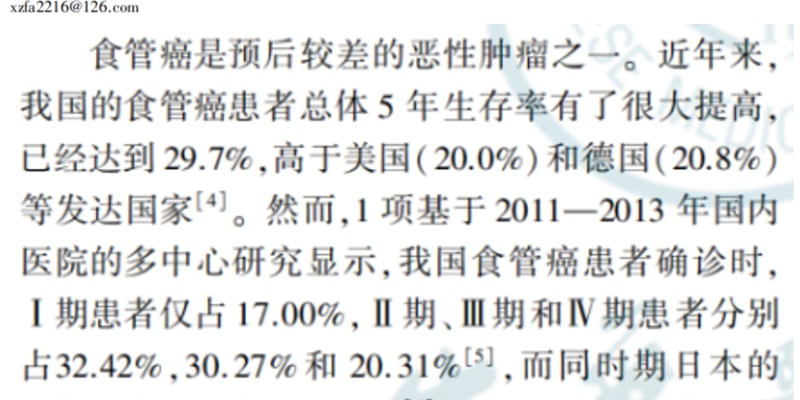
为了突破这一困境,一种名为压电催化治疗(Piezocatalytic Therapy)的新兴技术应运而生。这种疗法利用无创的超声波,像一把“钥匙”一样激活特定的压电纳米材料。这些材料在超声波的机械力作用下,能够产生电荷,进而催化周围的分子(如水)产生具有强大杀伤力的活性氧(Reactive Oxygen Species, ROS)。ROS就像微型“炸弹”,可以直接摧毁癌细胞。更重要的是,这个过程不依赖氧气,因此有望克服缺氧肿瘤微环境带来的治疗限制。凭借其深层组织穿透性和高时空精准性,压电催化治疗展现出了巨大的潜力。
技术瓶颈与创新思路:如何打造更强的“压电战士”?
尽管前景广阔,但现有的压电材料在实际应用中仍存在一个关键问题:产生的ROS数量有限,对肿瘤细胞的杀伤力不足,难以达到理想的治疗效果。过去的研究大多集中在优化材料的半导体性质上,却忽略了提升其核心“武器”——压电性能本身。
近日,一项发表在国际顶级期刊《Biomaterials》上的研究为我们带来了全新的解决方案。来自重庆大学的蔡开勇教授、漆超副教授及姚陈果教授团队,跳出了传统思维框架,通过一种巧妙的“梯度离子替换”策略,成功设计出一种“核-壳”结构的铜改性钛酸钡(Cu-BTO)纳米材料。这一创新不仅极大地增强了材料的压电效应,还赋予了其自我放大的类芬顿反应活性,为高效的肿瘤压电催化免疫治疗解锁了新的可能。

图1 Cu-BTO纳米材料的制备及其在超声触发下的抗肿瘤机制示意图
揭秘Cu-BTO:梯度“外壳”如何引爆压电潜能?
研究团队选择钛酸钡(BTO)作为基础材料,因为它具有良好的生物相容性和易于改造的结构。他们没有采用传统的均匀掺杂方法,而是独创性地开发了“两步梯度离子替换”技术,为BTO纳米颗粒“穿”上了一件特殊的铜离子“外衣”。
- 第一步:蚀刻“挖坑”。 研究人员首先用盐酸处理BTO表面,巧妙地“蚀刻”掉一些钡离子(Ba²⁺),制造出空位,为后续铜离子(Cu²⁺)的进入创造了条件。
- 第二步:水热“填坑”。 随后,通过水热处理,将铜离子精准地“嵌入”这些空位中,使BTO表面重新结晶,形成一个铜离子浓度从外到内逐渐降低的梯度壳层结构。
这个设计的精妙之处在于,它不仅解决了传统核壳材料制备中“晶格失配”的技术难题,更重要的是,在材料内部形成了应变梯度。这种梯度使得材料在受到超声波的机械压力时,能够产生更强的挠曲电效应和压电效应耦合,从而大幅提升其压电响应能力。这项前沿技术为癌症治疗带来了新的希望,如果您想了解更多最新的癌症治疗方案和药物信息,可以访问MedFind抗癌资讯平台,获取专业的解读和动态。

性能验证:压电效应飙升345.93%!
实验数据令人振奋。通过压电响应力显微镜(PFM)测试,研究团队发现,经过改造的Cu-BTO纳米材料的最大有效压电系数(d₃₃)达到了惊人的129.91 pm/V,相比原始的BTO材料提升了整整345.93%!这一数值显著优于近期报道的其他用于肿瘤治疗的压电纳米材料。同时,材料的半导体性质(如带隙结构、载流子传输性能)却与原始BTO保持一致,这证明了该策略在“专一”提升压电性能上的巨大成功。

图2 Cu-BTO材料的铁电和半导体性质表征
机制探索:双重效应协同增强
为什么Cu-BTO的压电性能会如此强大?研究团队通过密度泛函理论(DFT)计算和像差校正透射电子显微镜(AC-TEM)观察,揭示了其中的奥秘。增强的压电性能主要归因于两大关键因素:
- 晶格不对称性增加: 适量的铜离子取代增强了壳层晶格的内部不对称性,这是提升压电性能的基础。
- 应变梯度形成: 独特的梯度壳层结构导致在外力作用下产生不均匀的应变分布,即应变梯度,这进一步放大了压电响应。

图3 Cu-BTO压电响应增强的机制探究
多重打击:Cu-BTO如何高效杀灭癌细胞?
强大的压电性能转化为卓越的压电催化活性。在超声波的激发下,Cu-BTO展现出多管齐下的抗肿瘤能力:
- ROS风暴: Cu-BTO能够高效产生多种ROS,如羟基自由基(·OH)和单线态氧(¹O₂),直接对肿瘤细胞造成氧化损伤。
- 自增强的类芬顿反应: 材料中的铜离子赋予了其类芬顿催化活性,可以催化肿瘤内源性的过氧化氢(H₂O₂)产生更多·OH。更关键的是,超声波产生的内建电场能促进铜离子的价态循环(Cu²⁺/Cu⁺),实现催化活性的自我增强,形成一个持续高效的杀伤循环。
- 消耗肿瘤“保护伞”: Cu-BTO还能消耗肿瘤细胞内的谷胱甘肽(GSH),GSH是保护癌细胞免受氧化应激损伤的重要物质。耗尽GSH等于卸下了癌细胞的“铠甲”,使其更容易被ROS杀死。

图4 Cu-BTO的压电催化活性评估
从实验室到临床的希望:体内外实验验证强大疗效
体外细胞实验:精准诱导癌细胞“免疫性死亡”
在针对4T1肿瘤细胞的体外实验中,Cu-BTO本身显示出良好的生物相容性,对正常细胞几乎没有毒性。然而,一旦施加超声波,情况就发生了逆转。Cu-BTO+超声组能够有效破坏肿瘤细胞的氧化还原平衡,导致线粒体功能障碍,最终高效地杀死肿瘤细胞。
更重要的是,这种死亡方式是一种免疫原性细胞死亡(Immunogenic Cell Death, ICD)。简单来说,它不仅杀死了癌细胞,还让这些死亡的细胞变成“信使”,释放出如ATP、钙网蛋白(CRT)和高迁移率族蛋白B1(HMGB1)等“危险信号”。这些信号能够“唤醒”并激活免疫系统中的树突状细胞(DC),启动针对肿瘤的特异性免疫反应。理解这些复杂的生物学机制可能令人困惑,如果您对自己的治疗方案或前沿疗法有任何疑问,MedFind的AI问诊服务可以为您提供7×24小时的个性化信息支持。

图5 体外抗肿瘤效果评价
体内动物实验:有效抑制肿瘤生长与转移
在4T1荷瘤小鼠模型中,研究团队进一步验证了Cu-BTO的体内抗肿瘤效果。结果显示,接受Cu-BTO+超声治疗的小鼠,其肿瘤生长受到了显著抑制。通过组织切片分析,可以看到治疗组的肿瘤组织内部出现了大面积的细胞坏死,DNA发生断裂,肿瘤细胞的增殖活性也受到强烈抑制。
流式细胞术分析进一步证实,该疗法成功地在体内开启了强大的抗肿瘤免疫反应,显著增加了具有杀伤功能的免疫细胞在肿瘤局部的浸润。令人鼓舞的是,这种全身性的免疫激活还有效抑制了肿瘤的远处转移,这对于提高患者的长期生存率至关重要。

图6 体内抗肿瘤效果评价
总结与展望:压电催化免疫疗法的新篇章
这项研究的重大创新意义在于,它为提升压电催化治疗的效率提供了一条全新的、行之有效的路径。通过精巧的梯度离子替换策略,研究团队在不改变材料半导体性质的前提下,实现了压电性能的跨越式提升,并巧妙地集成了自增强的类芬顿反应,最终实现了高效的压电催化免疫治疗。
虽然这项技术目前仍处于临床前研究阶段,距离真正的临床应用还有一段路要走,但它无疑为攻克实体瘤,特别是那些对传统疗法不敏感的缺氧性肿瘤,提供了极具前景的新策略。我们期待这一技术能够不断完善,早日转化为能够造福广大癌症患者的临床治疗方案。对于正在寻求治疗方案的患者而言,获取可靠、有效的药物是治疗的基础。MedFind致力于为全球华人癌症患者提供便捷的海外创新药物直邮服务,确保您能及时、安全地获得所需治疗,为您的抗癌之路保驾护航。