“癌王”治疗困境与新希望
胰腺癌,因其恶性程度高、诊疗难度大而被称为“癌中之王”,其中胰腺导管腺癌(PDAC)最为常见,占比超过95%。长久以来,对于可手术切除的胰腺癌,医学界普遍采用“手术优先”的治疗模式,即先通过手术切除肿瘤,再进行术后辅助化疗。然而,这一传统策略面临着严峻的挑战:许多患者术后恢复不佳或肿瘤过早复发,导致无法顺利完成化疗;同时,手术难以清除体内潜藏的微小转移灶,术后复发风险极高。
为了破解这一难题,医学家们将目光转向了“新辅助治疗”,即在手术前进行化疗。其核心思路是“先清野,后攻城”,通过术前化疗先行消灭微转移灶、缩小肿瘤体积,从而提高手术的成功率和彻底性。尽管理念先进,但其在可切除胰腺癌中的实际疗效一直缺乏大型III期临床试验证据。对于复杂的治疗方案,患者可以咨询MedFind的AI问诊服务,获取个性化解读。
《Cancer Cell》重磅研究证实新疗法价值
近日,国际顶尖期刊《Cancer Cell》发表了一项由浙江大学医学院附属第一医院梁廷波教授团队主导的随机III期临床试验结果。这项研究首次以最高级别的循证医学证据,证实了一种创新的序贯新辅助化疗方案能够为可切除胰腺癌患者带来显著的生存获益。

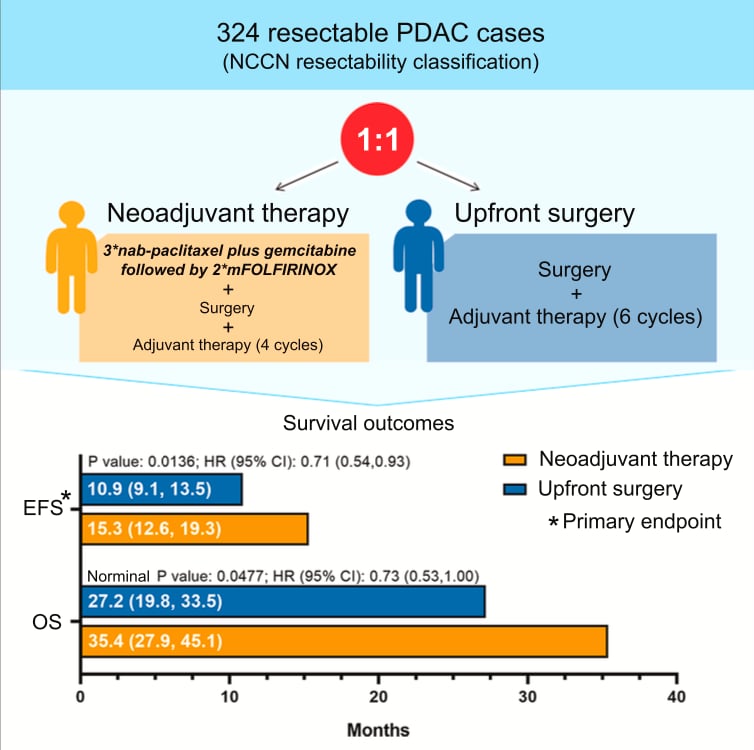
研究结果显示,与直接手术相比,采用白蛋白结合型紫杉醇联合吉西他滨,序贯改良FOLFIRINOX方案进行新辅助治疗,不仅显著延长了患者的无事件生存期(EFS),也展现出改善总生存期(OS)的积极趋势,且整个治疗过程的安全性良好可控。
研究设计与方案
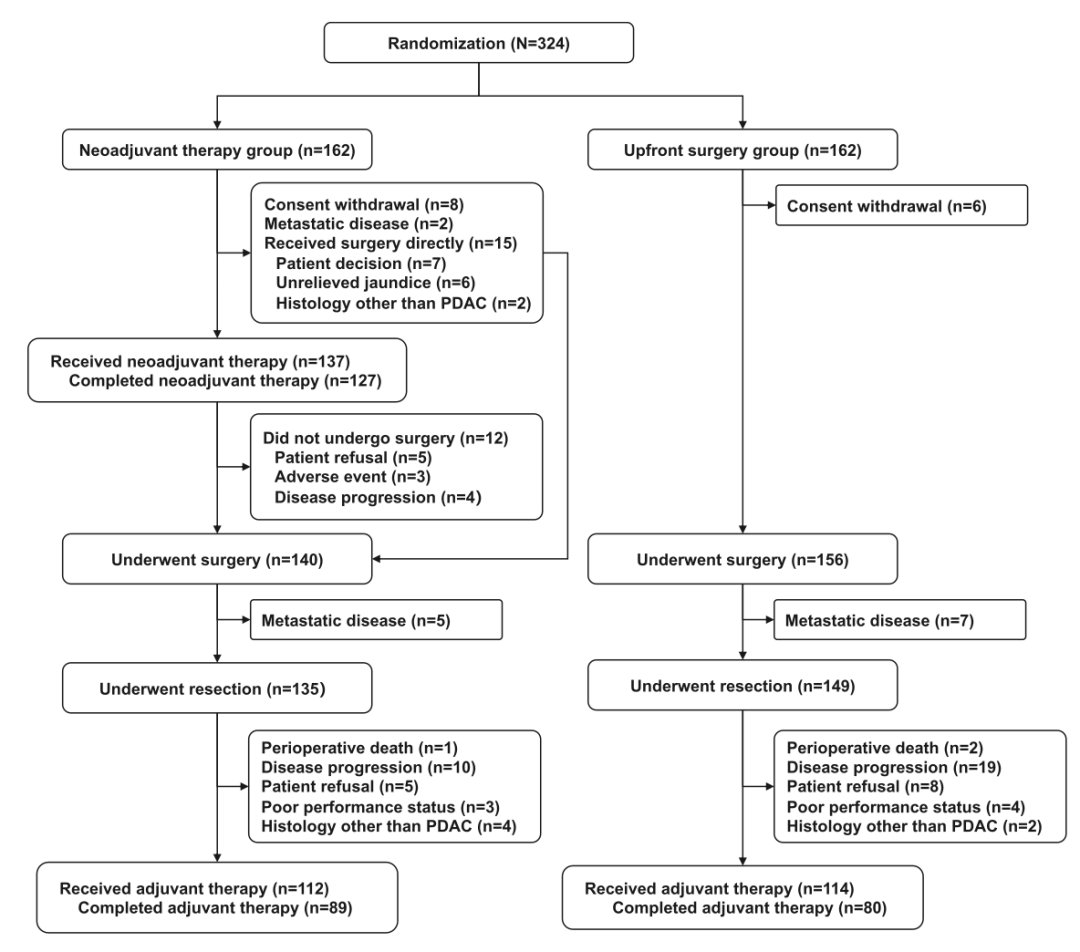
这项单中心、开放标签的III期试验(NCT03750669)共纳入了324名可切除胰腺癌患者,并将其1:1随机分为两组:
- 新辅助治疗组:术前接受3周期白蛋白结合型紫杉醇+吉西他滨治疗,随后进行2周期改良FOLFIRINOX方案化疗。手术后,再接受4周期辅助化疗。
- 直接手术组:按照传统模式,先行手术切除,术后接受6周期辅助化疗。
研究的主要终点是无事件生存期(EFS),次要终点包括总生存期(OS)、手术切除率和安全性等。
核心发现:新辅助化疗如何改善治疗效果?
1. 有效降低肿瘤负荷
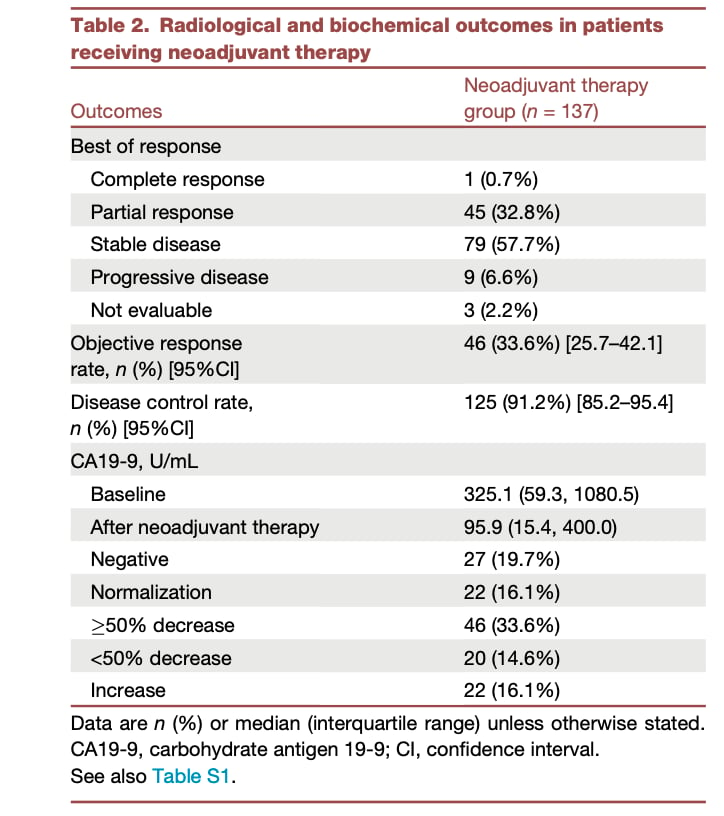
在新辅助治疗组,高达92.7%的患者完成了全部术前化疗。评估显示,该方案的客观缓解率(ORR)达到33.6%,疾病控制率(DCR)更是高达91.2%。此外,肿瘤标志物CA19-9的中位值也从治疗前的325.1 U/mL大幅降至95.9 U/mL,这表明新辅助治疗能有效缩小肿瘤,为后续手术创造了更优越的条件。
2. 提升手术质量
尽管新辅助治疗组的最终手术切除率(83.3%)略低于直接手术组(92.0%),但其手术质量却更高。新辅助治疗组的R0切除率(指手术切缘镜下无癌细胞残留)达到了87.4%,显著优于直接手术组的79.9%。更高的R0切除率意味着更彻底的肿瘤清除,是降低术后复发风险的关键。
生存数据解读:为患者带来切实获益
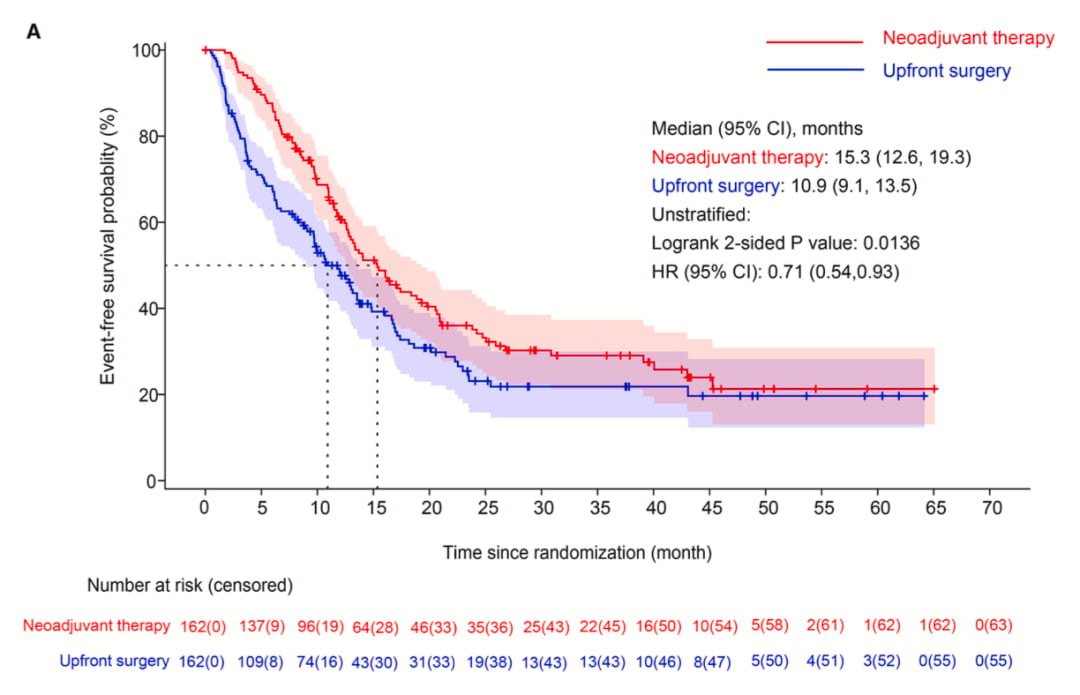
在中位随访18.7个月后,生存数据显示了新辅助治疗的巨大优势:
- 无事件生存期(EFS):新辅助治疗组的中位EFS为15.3个月,而直接手术组仅为10.9个月。这意味着新辅助治疗将疾病进展、复发或死亡的风险显著降低了29%(HR=0.71, P=0.0136)。
- 总生存期(OS):新辅助治疗组的中位OS长达35.4个月,相比直接手术组的27.2个月,延长了8.2个月,呈现出明确的生存获益趋势(HR=0.73, P=0.0477)。
安全性评估:新方案是否增加手术风险?
安全性是评估新疗法的重要指标。研究显示,新辅助治疗的副作用是可控的,最常见的≥3级不良事件为中性粒细胞减少(34.3%),但均可通过医疗干预得到有效管理。至关重要的是,术前化疗并未增加手术的难度和风险,两组的严重手术并发症发生率和围手术期死亡率均无显著差异,证明了该方案在临床实践中的可行性与安全性。

结语
这项发表于《Cancer Cell》的III期临床试验,为可切除胰腺癌的治疗模式带来了革命性的转变。它强有力地证明了“先化疗、后手术”的新辅助治疗策略,能够有效提高手术质量,并最终转化为患者实实在在的生存获益。这一突破性成果,有望在未来改写胰腺癌的临床诊疗指南。MedFind致力于帮助患者获取全球最新的治疗药物,如需了解相关药物的代购信息,可访问MedFind全球靶向药代购商城,同时也可以在MedFind资讯中心获取更多前沿抗癌资讯。





