颠覆认知:肿瘤细菌的“物理攻击”
长期以来,化疗耐药是结直肠癌、口腔鳞癌等多种癌症治疗中的棘手难题。科学家们普遍认为,肿瘤微环境中的细菌主要通过代谢产物等化学方式影响癌细胞。然而,一项发表于顶尖期刊《Cancer Cell》的最新研究彻底颠覆了这一认知,揭示了一个前所未有的物理性耐药机制。
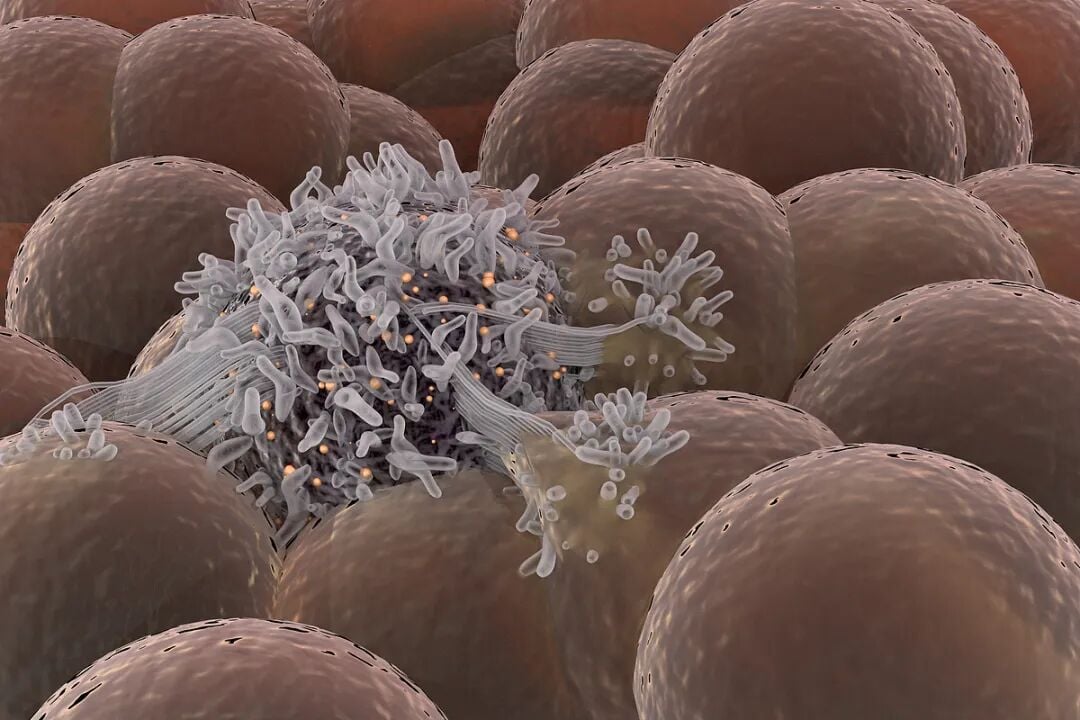
研究人员通过高分辨率空间成像技术分析患者的肿瘤样本发现,在细菌高度富集的区域,这些微生物并非侵入癌细胞内部,而是大量存在于细胞外部,形成高密度的“微灶”。它们像楔子一样挤在肿瘤细胞之间,极大地改变了肿瘤组织的结构,使得原本紧密排列的癌细胞变得稀疏松散。

这一现象在小鼠模型中也得到了证实。当研究者将从结直肠癌患者体内分离出的具核梭杆菌(Fusobacterium nucleatum)注入结肠癌小鼠体内后,观察到了与人类肿瘤中高度一致的现象,证实了是细菌主动造成了这种物理空间的重塑。
癌细胞的“休眠”策略:细菌如何导致化疗耐药?
这种“霸道”的物理挤压,究竟如何影响癌细胞的行为呢?研究发现,这非但没有杀死癌细胞,反而触发了它们的“生存智慧”——进入休眠模式。
活细胞成像技术直观地展示了这一过程:具核梭杆菌通过物理性占位,强行破坏了癌细胞之间的连接,迫使它们彼此分离。作为应激反应,这些被“挤散”的肿瘤细胞大量停滞在细胞周期的G0-G1期,即进入了静息状态,暂停了分裂和增殖。
而化疗药物,如经典的5-氟尿嘧啶,其作用机制正是靶向快速分裂的细胞。因此,当癌细胞进入“休眠”状态后,便对这类药物产生了天然的抵抗力。实验证明,经过细菌干扰的肿瘤细胞在化疗药物攻击后,存活率和恢复能力都显著增强。面对复杂的化疗耐药问题,寻求更前沿的治疗方案至关重要。MedFind致力于提供全球最新的靶向药物代购服务,帮助患者链接希望。
临床证据:从实验室到真实世界的验证
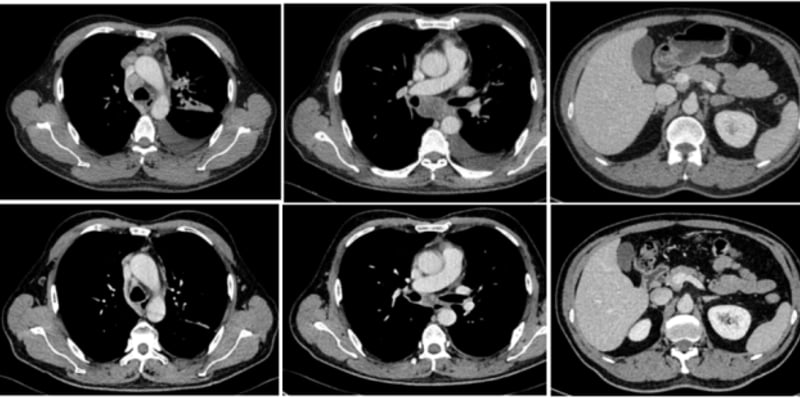
为了验证这一发现的临床相关性,研究团队回顾性分析了一个包含92名结直肠癌患者的临床队列。结果清晰地表明:对术前新辅助化疗反应不佳的患者,其肿瘤组织中的具核梭杆菌载量显著更高。
借助尖端的空间单细胞转录组学技术,研究者得以在分子层面描绘这些细胞的状态。他们发现,在细菌富集的微区域内,肿瘤细胞的细胞周期、转录和翻译等相关功能几乎完全停滞,从基因层面证实了其深度“休眠”的状态。
更值得警惕的是,这些休眠细胞还下调了抗原呈递和细胞黏附相关的分子,这不仅可能帮助它们逃避免疫系统的监视,还可能赋予其更强的侵袭性。当治疗方案因耐药而陷入瓶颈时,不妨尝试MedFind AI问诊,获取基于最新研究的个性化治疗建议。
未来启示:抗癌治疗的新方向
这项研究从一个全新的物理学视角,揭示了肿瘤微环境中的细菌如何通过改变癌细胞的物理排列和接触方式,直接诱导其进入休眠状态,进而产生对化疗的抵抗。这一发现不仅为理解化疗耐药提供了全新的理论框架,也为开发新的抗癌策略指明了方向。
未来,针对肿瘤内细菌的物理干扰,例如通过特定手段清除这些“占位”细菌或破坏其聚集,可能成为克服化疗耐药、提高治疗效果的创新疗法。要深入了解更多类似的前沿抗癌资讯,为治疗决策提供参考,欢迎访问MedFind抗癌资讯板块。