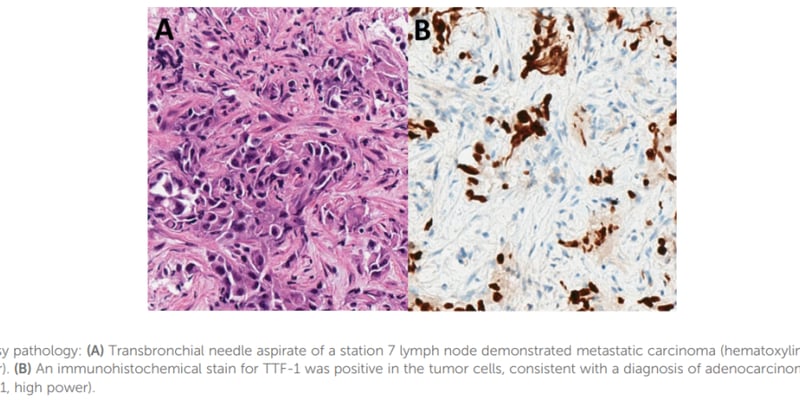
胃癌治疗领域迎来重磅消息
美国食品药品监督管理局(FDA)已授予PD-L1抑制剂度伐利尤单抗(Durvalumab),商品名为英飞凡(Imfinzi),一项优先审评资格。该资格针对其补充生物制品许可申请(sBLA),用于治疗可切除的早期、局部晚期胃癌和胃食管交界部(GEJ)癌患者。同时,FDA还授予了度伐利尤单抗在该适应症中的突破性疗法认定。
这一积极进展意味着,对于许多术后仍面临高复发风险的胃癌患者而言,一种全新的、更有效的治疗模式可能即将问世。FDA预计将在2024年第四季度对该申请做出审评决定。
MATTERHORN研究:疗效数据令人鼓舞
此次申请主要基于一项名为MATTERHORN的全球、随机、双盲、安慰剂对照的III期临床试验(NCT04592913)的卓越数据。该研究旨在评估在围手术期(术前新辅助和术后辅助)将度伐利尤单抗联合标准化疗方案FLOT(氟尿嘧啶、亚叶酸、奥沙利铂、多西他赛)用于可切除胃癌/GEJ癌的疗效。
在2024年ASCO年会上公布的中期分析结果显示,与单纯使用FLOT化疗的患者相比:
- 接受度伐利尤单抗联合方案治疗的患者,其疾病进展、复发或死亡的风险显著降低了29%(HR, 0.71; 95% CI, 0.58-0.86; P
- 度伐利尤单抗组的中位无事件生存期(EFS)尚未达到,而化疗组为32.8个月,显示出持久的获益。
- 在病理完全缓解(pCR)率方面,度伐利尤单抗组达到了19.2%,远高于化疗组的7.2%。
- 两年总生存(OS)率方面,度伐利尤单抗组为75.7%,而化疗组为70.4%。
阿斯利康肿瘤研发执行副总裁Susan Galbraith表示:“这一优先审评资格肯定了度伐利尤单抗围手术期疗法在改变早期胃癌和GEJ癌治疗格局方面的潜力。这是唯一在该适应症中显示出能显著降低疾病进展、复发或死亡风险的免疫疗法方案,一旦获批,将有望重塑临床实践。”
创新的围手术期免疫联合化疗方案
MATTERHORN研究采用的“围手术期”治疗模式,具体指患者在接受根治性手术之前,先接受2个周期的度伐利尤单抗(或安慰剂)联合FLOT化疗(新辅助治疗);手术后,再接受2个周期的联合治疗以及后续10个周期的度伐利尤单抗(或安慰剂)单药维持治疗(辅助治疗)。这种全程管理的模式旨在最大程度地清除微小病灶,降低术后复发风险。
安全性与潜在副作用
对于患者和医生关心的安全性问题,研究数据显示,度伐利尤单抗联合FLOT化疗的安全性特征与各项疗法已知的安全性信息基本一致,未发现新的安全信号。3/4级不良事件(AEs)的发生率在度伐利尤单抗组和安慰剂组中相似(分别为71.6% vs 71.2%),表明增加免疫治疗并未显著增加严重毒性。此外,两组患者中出现手术延迟或辅助治疗延迟启动的比例也相近。
这一突破性进展为胃癌和胃食管交界癌患者带来了新的治疗选择。如果您想了解更多关于度伐利尤单抗(英飞凡)的详细信息,包括其在海外的最新价格、购买或代购途径,可以咨询MedFind的AI问诊服务,获取专业的解答和帮助。